Hoà tan hoàn toàn 10 gam oxit của một kim loại trong dung dịch HCl. Cô cạn dung dịch sau phản ứng thu được 23,75 gam muối. Kim loại đó là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CTHH oxit : $R_2O$
$n_{HCl} = \dfrac{3,65}{36,5} = 0,1(mol)$
\(R_2O+2HCl\rightarrow2RCl+H_2O\)
0,05 0,1 0,1 (mol)
\(R_2O+H_2O\rightarrow2ROH\)
x 2x (mol)
Ta có :
$m_{R_2O} = (0,05 + x)(2R + 16) = 9,4(gam)$
$\Rightarrow 0,1R + 2Rx + 16x = 8,6$(1)
$m_{chất\ rắn} = m_{RCl} + m_{ROH} = 0,1(R + 35,5) + 2x(R + 17)=13,05$
$\Rightarrow 0,1R + 2Rx + 34x = 9,5$(2)
Lấy (2)- (1) : $18x = 0,9 \Rightarrow x = 0,05$
$n_{R_2O} = 0,05 + x = 0,1(mol)$
$\Rightarrow M_{R_2O} = 2R + 16 = \dfrac{9,4}{0,1} = 94$
$\Rightarrow R = 39(Kali)$

Đáp án B
M + 2HCl → MCl2 + H2
M (M+71)
8,45g 17,68g
=> 17,68.M = 8,45.(M+71)
=> M = 65 (Zn)

Đáp án B
M + 2HCl -> MCl2 + H2
M g (M + 71)g
8,45g 17,68g
=> 17,68.M = 8,45.(M + 71)
=> M = 65g (Zn)

Giải thích: Đáp án C
BTKL: nCl- = ( mmuối – mKL)/35,5 = ( 17,68 – 8,45) / 35,5 = 0,26 (mol) = nHCl
M + 2HCl → MCl2 + H2↑
0,13 ← 0,26 (mol)
=> MM = 8,45 : 0,13 = 65 (Zn)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ \Rightarrow n_{HCl}=2.n_{H_2}=2.0,4=0,8\left(mol\right)\\ Ta.có:m=m_{muối}=m_{kl}+\left(m_{HCl}-m_{H_2}\right)=11,2+\left(0,8.36,5-0,4.2\right)=39,6\left(g\right)\)

Đáp án C
Ta có: M + 2HCl → MCl2 + H2↑.
+ Ta có mCl = 17,68 – 8,45 = 0,26 mol = ne trao đổi.
⇒ nM = 0,26÷2 = 0,13 mol.
⇒ MM = 8,45 ÷ 0,13 = 65
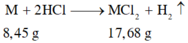
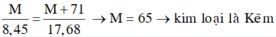
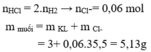
Gọi oxit của kim loại đó là A2On
\(n_{A_2O_n}=\dfrac{10}{2.M_A+16n}=\dfrac{5}{M_A+8n}\left(mol\right)\)
PTHH: A2On + 2nHCl --> 2ACln + nH2O
=> \(n_{ACl_n}=\dfrac{10}{M_A+8n}\left(mol\right)\)
=> \(M_{ACl_n}=M_A+35,5n=\dfrac{23,75}{\dfrac{10}{M_A+8n}}\left(g/mol\right)\)
=> MA = 12n (g/mol)
- Nếu n = 1 => MA = 12 (loại)
- Nếu n = 2 => MA = 24(Mg)
- Nếu n = 3 => MA = 36 (Loại)
Vậy kim loại đó là Mg