Hoà tan a gam hỗn hợp gồm Fe, FeO, Fe2O3 bằng dd hcl dư thì lượng H2 thu được bằng 1%khối lượng hỗn hợp. Mặt khác, nếu khử hoàn toàn a gam hỗn hợp bằng H2 nóng, dư thì thu được lượng nước bằng 21,15% khối lượng hỗn hợp Xác định thành phần % mỗi chất trg hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử khối lượng hỗn hợp a là 100g
Gọi số mol Fe, FeO và Fe2O3 lần lượt là x, y, z
->56x+72y+160z=100 (1)
Vì khối lượng H2 thoát ra bằng 1,00% khối lượng hỗn hợp đem thí nghiệm mH2=1%.100=1g
=> nH2=\(\dfrac{1}{2}\)=0,5mol
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT nFe = nH2 = 0,5mol =x (2)
Vì khử a gam hỗn hợp trên bằng H2 dư thì thu được khối lượng nước bằng 21,15% lượng hỗn hợp đem thí nghiệm.
=> mH2O=21,15%.100 = 21,15g
->nH2O=\(\dfrac{21,15}{18}\)=1,175mol
PTHH: \(FeO+H_2\rightarrow Fe+H_2O\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Ta có: \(n_{H_2O}=\) y+3z=1,175 (3)
Từ (1), (2), (3) =>x=0,5; y=0,5; z=0,225
->%mFe=\(\dfrac{0,5.56}{100}=28\%\)
->%mFeO=\(\dfrac{0,5.72}{100}=36\%\)
->%mFe2O3=100-28-36 = 36%

Giả sử a=100(g)
Fe2O3+6HCl→2FeCl2+h2o
Gọi a,b lần lượt là số mol của FeO, Fe2O3 (a,b > 0 )
%mFe=28%
%mFeO=0,5.72=36%
%mFe2O3=36%.

Giả sử \(a=100\left(g\right)\)
\(\Rightarrow m_{H_2}=1\%.100=1\left(g\right)\Rightarrow n_{H_2}=0,5\left(mol\right)\)
\(Fe\left(0,5\right)+2HCl\rightarrow FeCl_2+H_2\left(0,5\right)\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(\Rightarrow m_{FeO,Fe_2O_3}=100-0,5.56=100-28=72\left(g\right)\)
Gọi a,b lần lượt là số mol của FeO, Fe2O3 (a,b > 0 )
\(\Rightarrow72a+160b=72\left(I\right)\)
\(FeO\left(a\right)+H_2\rightarrow Fe+H_2O\left(a\right)\)
\(Fe_2O_3\left(b\right)+3H_2\rightarrow2Fe+3H_2O\left(3b\right)\)
\(m_{H_2O}=21,15\%.100=21,15\left(g\right)\)
\(\Rightarrow a+3b=\dfrac{21,15}{18}=1,175\left(II\right)\)
Từ (I) và (II) \(\Rightarrow a=0,5;b=0,225\)
\(\%m_{Fe}=28\%\)
\(\%m_{FeO}=0,5.72=36\%\)
\(\%m_{Fe_2O_3}=36\%.\)

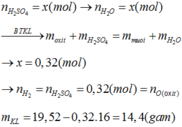
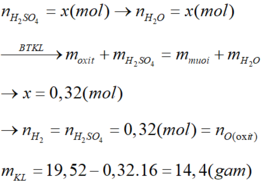
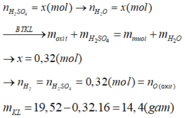


\(m_{H_2}=0,01a\left(g\right)\)
=> \(n_{H_2}=\dfrac{0,01a}{2}=0,005a\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,005a<----------------0,005a
=> mFe = 56.0,005a = 0,28a (g)
Gọi số mol FeO, Fe2O3 là x, y (mol)
=> 72x + 160y = a - 0,28a = 0,72a (1)
\(m_{H_2O}=0,2115a\left(g\right)\)
=> \(n_{H_2O}=\dfrac{0,2115a}{18}=0,01175a\left(mol\right)\)
PTHH: FeO + H2 --to--> Fe + H2O
x---------------------->x
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
y----------------------------->3y
=> x + 3y = 0,01175a (2)
(1)(2) => \(\left\{{}\begin{matrix}x=0,005a\left(mol\right)\\y=0,00225a\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,28a}{a}.100\%=28\%\)
\(\%FeO=\dfrac{72.0,005a}{a}.100\%=36\%\)
\(\%Fe_2O_3=\dfrac{160.0,00225a}{a}.100\%=36\%\)
\(m_{H_2}=0,01a\left(g\right)\\ \Rightarrow n_{Fe}=n_{H_2}=0,005a\left(mol\right)\\\Rightarrow m_{FeO,Fe_2O_3}=a-0,005a.56=0,72a\\ Đặt:n_{FeO}=x\left(mol\right);n_{Fe_2O_3}=y\left(mol\right)\left(x,y>0\right)\\ \Rightarrow72x+160y=0,72a\left(1\right)\\ m_{H_2O}=0,2115a\\ \Leftrightarrow18x+54y=0,2115a\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\dfrac{504}{47}x=\dfrac{1120}{47}y\\ \Rightarrow\dfrac{x}{y}=\dfrac{\dfrac{1120}{47}}{\dfrac{504}{47}}=\dfrac{20}{9}\\ \Rightarrow\%m_{Fe}=\dfrac{0,28a}{a}.100=28\%\\Ta.có:x.72+0,45x.160=0,72a\\ \Leftrightarrow144x=0,72a\\ \Leftrightarrow\dfrac{x}{a}=\dfrac{0,72}{144}=0,005\\ \Rightarrow\%m_{FeO}=\dfrac{72.0,005a}{a}.100=36\%\)
\(\Rightarrow\%m_{Fe_2O_3}=100\%-\left(28\%+36\%\right)=36\%\)