Hòa tan 34,8 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4, Al2O3 cần dùng vừa đủ 200 ml dung dịch gồm HCl 4M
và HBr 2M. Sau phản ứng cô cạn dd thu được m gam hỗn hợp muối khan. Giá trị m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HCl}=0,1.0,3=0,03\left(mol\right)\)
=> \(n_{H_2O}=\dfrac{0,03}{2}=0,015\left(mol\right)\)
Theo ĐLBTKL: \(m_{oxit}+m_{HCl}=m_{muối}+m_{H_2O}\)
=> mmuối = 3,425 + 0,03.36,5 - 0,015.18 = 4,25(g)

Đáp án C
X F e O , F e 2 O 3 , F e 3 O 4 → + H N O 3 0 , 2 m o l N O + F e N O 3 3
Khối lượng muối thu được chỉ chứa Fe(NO3)3 → nFe(NO3)3 = 145,2 : 242= 0,6 mol
Coi hỗn hợp X chứa Fe: 0,6 mol và O: x mol
Bảo toàn electron : → 0,6×3= 2x+ 0,2 ×3 → x = 0,6 mol
→ m= mFe + mO = 0,6×56 + 0,6×16 = 43,2 gam

n HCl = \(0,796.2\) =1,592 (mol)
n H2 = \(\dfrac{4,368}{22,4}\)=0,195 (mol)
Bảo toàn nguyên tố H
=> n H2O =\(\dfrac{1,592-0,195.2}{2}\) = 0,601 (mol)
=> m H2O = 10,818 g
Áp dụng định luật bảo toàn khối lượng :
m muối khan = m hỗn hợp + m axit - m H2O - mH2
=> 26,43 + 1,592.36,5 - 10,818 - 0,195.2
= 73,33 g

bảo toàn khối lượng:5,18 + 0,1.0,5.98 - 0,5.0,1.18 = 9,18 gam
=> Đáp án A


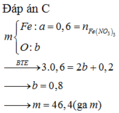


\(\left\{{}\begin{matrix}n_{HCl}=0,2.4=0,8\left(mol\right)\\n_{HBr}=0,2.2=0,4\left(mol\right)\end{matrix}\right.\)
=> \(n_{H_2O}=0,6\left(mol\right)\)
=> nO = 0,6 (mol)
=> mkim loại = 34,8 - 0,6.16 = 25,2 (g)
=> mmuối = 25,2 + 0,8.35,5 + 0,4.80 = 85,6 (g)
sao ra chỗ số mol của nước bằng 0,6 vậy ạ