HH khí A gồm CO và một hidro cacbon. Để đốt cháy hoàn toàn 6,72 lít khí A, phải dùng vừa hết 39,2 lít không khí. Phản ứng tạo thành 8,96 lít CO2 và 1,8 g H2O.
Xác định công thức phân tử của hidro cacbon và thành phần % theo thể tích các khí trong hh A. Biết oxi chiếm 20% thể tích không khí, các khí đều đo ở đktc

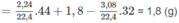
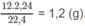
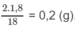
 (butanal)
(butanal)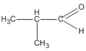 (2-metylpropanal)
(2-metylpropanal)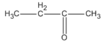 (butan-2-ol)
(butan-2-ol)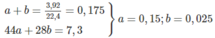
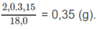

Gọi số mol CO, CxHy trong A là a, b
=> \(a+b=\dfrac{6,72}{22,4}=0,3\)
\(n_{O_2}=\dfrac{39,2}{22,4}.20\%=0,35\left(mol\right)\)
\(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
Bảo toàn C: a + bx = 0,4
Bảo toàn H: by = 0,2
Bảo toàn O: a + 0,7 = 0,8 + 0,1 => a = 0,2 (mol) => b = 0,1 (mol)
=> bx = 0,2 (mol)
\(\left\{{}\begin{matrix}x=\dfrac{0,2}{b}=\dfrac{0,2}{0,1}=2\\y=\dfrac{0,2}{b}=\dfrac{0,2}{0,1}=2\end{matrix}\right.\)
=> CTPT: C2H2
\(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%V_{C_2H_2}=\dfrac{0,1}{0,3}.100\%=33,33\%\end{matrix}\right.\)