Khử 28,8 gam copper (II) oxide bằng khí hydrogen
a) Tính thể tích khí hydrogen cần dùng ở đkc
b) TÍnh khối lượng kim loại đồng tạo thành ( Cu=64, O=16, H=1)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Cu}=n_{H_2O}=n_{CuO}=0,15\left(mol\right)\)
b, \(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{H_2O}=0,15.18=2,7\left(g\right)\)
c, \(V_{H_2}=0,15.24,79=3,7185\left(l\right)\)

nFe2O3 = 32/160 = 0,2 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
Mol: 0,2 ---> 0,6 ---> 0,4
mFe = 0,4 . 56 = 22,4 (g)
VH2 = 0,6 . 24,79 = 14,874 (l)

\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH:
Mg + 2HCl ---> MgCl2 + H2
0,3-->0,6----------------->0,3
=> \(\left\{{}\begin{matrix}V_{H_2}=24,79.0,3=7,437\left(l\right)\\m_{HCl}=0,6.36,5=21,9\left(g\right)\end{matrix}\right.\)
\(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,15 < 0,3 => H2 dư, vậy H2 khử hết CuO
a, \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Mg + 2HCl -----> MgCl2 + H2
0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
CuO + H2 -----> Cu + H2O
Ta có: \(\dfrac{0,15}{1}< \dfrac{0,3}{1}\) ⇒ CuO hết, H2 dư

`n_[CuO]=[0,8]/80=0,01(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,01` `0,01` `0,01` `(mol)`
`a)m_[Cu]=0,01.64=0,64(g)`
`b)V_[H_2]=0,01.22,4=0,224(l)`
`c)`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,01` `0,02` `0,01` `(mol)`
`@m_[Fe]=0,01.56=0,56(g)`
`@m_[dd HCl]=[0,02.36,5]/20 . 100=3,65(g)`

\(n_{O_2}=\dfrac{2,479}{24,79}=0,1(mol)\\ 2Cu+O_2\xrightarrow{t^o}2CuO\\ \Rightarrow n_{CuO}=0,2(mol)\\ \Rightarrow m_{CuO}=0,2.80=16(g)\)

\(n_{Cu}=\dfrac{2,56}{64}=0,04mol\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
0,04 0,02 0,04
\(V_{O_2}=0,02\cdot22,4=4,48l\)
\(m_{CuO}=0,04\cdot80=3,2g\)
nCu = 2,56 : 64 =0,04 (mol)
pthh : 2Cu + O2 -t--> 2CuO
0,04->0,02----->0,04 (mol)
VO2 = 0,02 .22,4 =0,448 (l)
mCuO = 0,04 . 80 =3,2 (g)
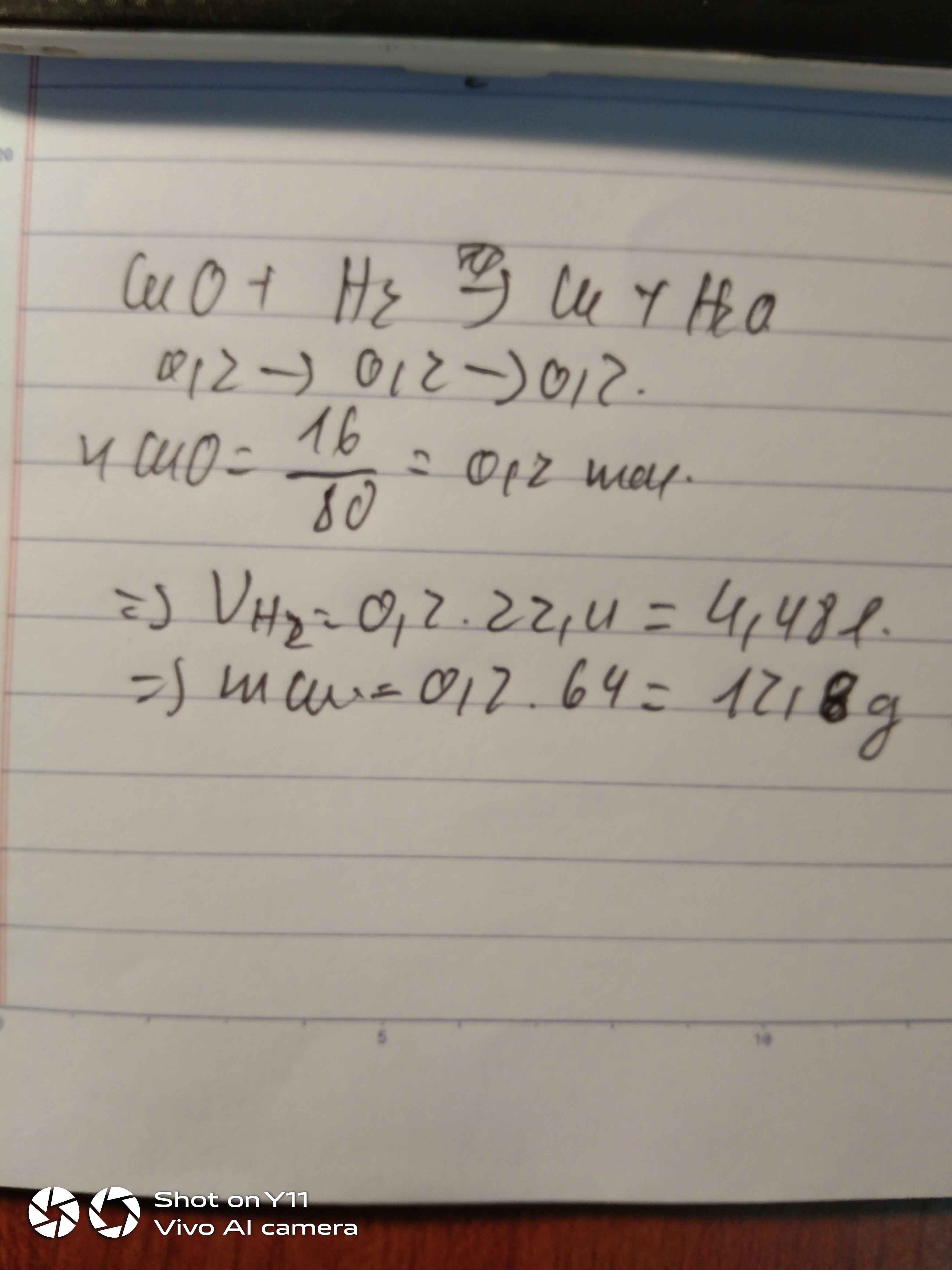
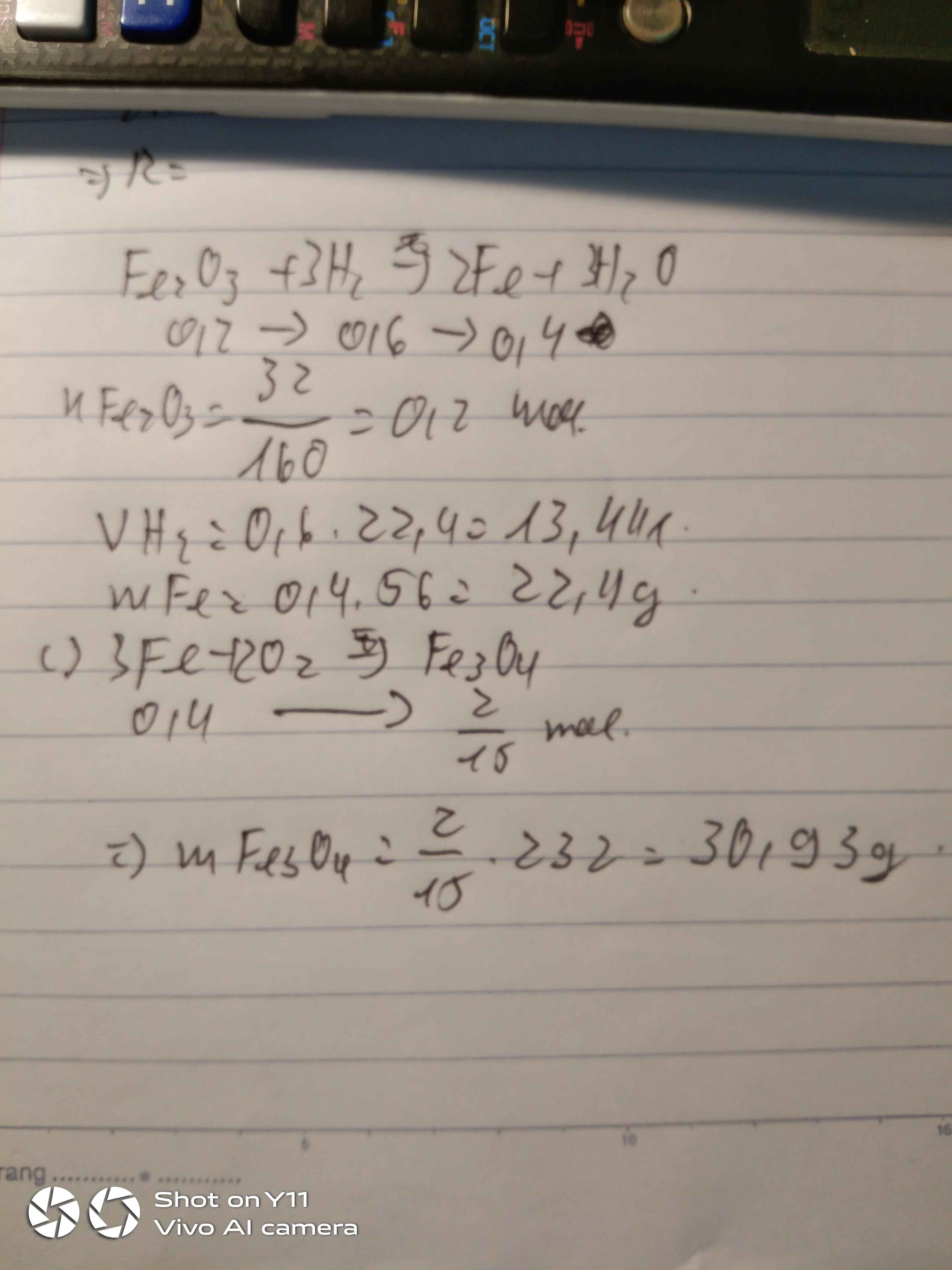
a. \(n_{Cu}=\dfrac{28.8}{64}=0,45\left(mol\right)\)
PTHH : CuO + H2 -> Cu + H2O
0,45 0,45 0,45 0,45
\(V_{H_2}=0,45.22,4=10,08\left(l\right)\)
b. \(m_{Cu}=0,45.64=28,8\left(g\right)\)
ncu = 28,8/64 = 0,45 mol
CuO + H2 -> Cu + H2O
1 : 1 : 1 : 1
0,45mol
a) nH2 = (0,45.1) : 1 = 0,45 mol
VH2 = 0,45 . 22,4 = 10,08 ( l )
b) mCu = 0,45 . 64 = 28,8 ( g)