Câu 1: Một oxit của nito có tỉ khối so với H2 là 23. Công thức hoá học của oxit đó là:
a.NO B. NO2 C. N2O3 D. N2O5
Câu 2: Nhiệt phân hoàn toàn 47,4g KMnO4. Thể tích khí O2 sinh ra ở đktc là
A. 0,336 (l) B. 0,762 (l) C. 3,36 (l) D. 6,72 (l)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức hóa học của oxit là N x O y
Tỉ số khối lượng:
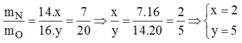
Vậy công thức hóa học của oxit Nito là: N 2 O 5 .
→ Chọn D.

n X = 6 , 048 22 , 4 = 0 , 27 m o l .
Đặt
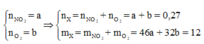
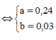

Cách 1: Áp dụng định luật bảo toàn khối lượng, không xét đến trong quá trình nhiệt phân A có thay đổi số oxi hóa hay không.Áp dụng định luật bảo toàn khối lượng ta có:
![]()
Bảo toàn nguyên tố N:
![]()

![]()
Vậy đáp án đúng là D.
Cách 2: Xét tỉ lệ mol giữa NO2 và O2 để tìm dạng phản ứng nhiệt phân của A(NO3)2 . Có
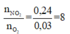
Khi đó trong quá trình nhiệt phân, A có sự thay đổi số oxi hóa từ +2 lên +3:
![]()
Quan sát 4 đáp án nhận thấy chỉ có Fe(NO3 )2 thỏa mãn.
Đáp án D.

a.b.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,2 0,1 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,1.22,4=2,24l\)
c.\(3Fe+2O_2\rightarrow Fe_3O_4\)
0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,05.232=11,6g\)

a.b.\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,1 0,05 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12l\)
c.\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,05 0,025 ( mol )
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,025.232=5,8g\)

1/
\(MA=15.2=\dfrac{30g}{mol}\)
\(nC=\dfrac{\dfrac{80.30}{100}}{12}=2\left(mol\right)\)
\(nH=\dfrac{\dfrac{20.30}{100}}{1}=6\left(mol\right)\)
Vậy CTPT của A là \(C_2H_6\)
2/
pthh:
\(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2\uparrow+6H_2O\)
2mol 7mol 4mol 6mol
\(nO_2=\dfrac{6}{32}=0,1875\left(mol\right)\)
\(\Rightarrow nCO_2=\dfrac{4}{7}.nO_2=\dfrac{4}{7}.0,1875=0,11\left(mol\right)\)
\(mCO_2=0,11.\left(12+16.2\right)=4,7\left(g\right)\)
\(nH_2O=\dfrac{6}{7}.nO_2=\dfrac{6}{7}.0,1825=0,156\left(mol\right)\)
\(mH_2O=0,156.18=2,82\left(g\right)\)
ui sr cái cuối kêu đi tính V ko khí , bổ sung lại :
\(VO_2=0,1875.22,4=4,2\left(l\right)\)
\(\Rightarrow V_{kk}=5.VO_2=5.4,2=21\left(l\right)\)

\(Fe_xO_y\)
\(n_{Fe_2O_n}=\dfrac{34,8}{56x+16n}\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(\dfrac{34,8}{56x+16y}\) -----> \(\dfrac{34,8x}{56x+16y}\) ( mol )
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,45 0,45 ( mol )
Ta có:
\(\dfrac{34,8x}{56x+16y}=0,45\)
\(\Leftrightarrow34,8x=25,2x+7,2y\)
\(\Leftrightarrow x=0,75y\)
\(\Leftrightarrow4x=3y\)
\(\Leftrightarrow x=3;y=4\)
\(\Rightarrow CTHH:Fe_3O_4\)

Gọi CT oxit sắt đó là FexOy.
PT: \(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
Ta có: \(n_{Fe}=\dfrac{4,2}{56}=0,075\left(mol\right)\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{x}n_{Fe}=\dfrac{0,075}{x}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{6}{\dfrac{0,075}{x}}=80x\left(g/mol\right)\)
\(\Rightarrow56x+16y=80x\Rightarrow24x=16y\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit sắt đó là Fe2O3.
Theo PT: \(n_{H_2}=\dfrac{y}{x}n_{Fe}=\dfrac{3}{2}.0,075=0,1125\left(mol\right)\Rightarrow V_{H_2}=0,1125.22,4=2,52\left(l\right)\)
1.
\(\dfrac{M_{NxOy}}{H2}=23\Rightarrow M_{NxOy}=46\Rightarrow CT:NO_2\)
⇒ Chọn B
2.
\(2KMnO4->K2MnO4+MnO2+O2\)
\(nKMnO4=\dfrac{47,4}{158}=0,3\left(mol\right)\)
\(\Rightarrow nO2=0,15\left(mol\right)\)
\(\Rightarrow V=0,15.22,4=3,36\left(l\right)\)
⇒ Chọn C
1. No2 2.C