hỗn hợp x gồm a mol co2 b mol h2 c mol so2. hỏi a,b,c phải có tỉ lệ như thế nào để tỉ khối của X so với o2 = 1,375 giải thích chi tiết giúp mình với ạ mình mới ra tới bước Mx =44 thôi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Mx=\)44g/mol
-> \(\frac{44a+2b+64c}{a+b+c}=44\)
-->\(b:c=10:21\)
Vậy với a bất kì và \(b:c=10:21\) thì tỉ khối của X so với khí oxi bằng 1,375
Tại sao lại vs bất kì a và b:c=10:21 thì tỉ khối của X so vs khí oxi bằng 1,375.

\(\overline{M_{hh}}\) = 1,375x 32 = 44 (g/mol)
=>\(\dfrac{44a+2b+64c}{a+b+c}\) = 44
=> 44a + 2b + 64c = 44a + 44b + 44c
=> 2b + 64c = 44b +44c
=> 42b = 20c
=> b:c = 20: 42 = 10: 21
Vì MCO2 = 44 (g/mol)
=> Tỉ khối của X chỉ phụ thuộc vào tỉ lệ mol của H2 và SO2
=> a:b:c = a: 10: 21

\(a.\)
\(m_{hh}=m_{SO_2}+m_{CO_2}=0.15\cdot64+0.2\cdot44=18.4\left(g\right)\)
\(n_{hh}=0.15+0.2=0.35\left(mol\right)\)
\(\overline{M}_X=\dfrac{m_{hh}}{n_{hh}}=\dfrac{18.4}{0.35}=52.5\left(\dfrac{g}{mol}\right)\)
\(b.\)
\(d_{X\text{/}NO_2}=\dfrac{52.57}{46}=1.14\)

Đặt \(\hept{\begin{cases}a\left(mol\right)=n_{H_2}=n_{O_2\left(A\right)}\\2b\left(mol\right)=n_{Cl_2}\\3b\left(mol\right)=n_{O_2\left(B\right)}\end{cases}}\)
\(\overline{M_A}=\frac{2a+16.2a}{a+a}=\frac{34a}{2a}=17g/mol\)
\(\overline{M_B}=\frac{2b.71+3b.16.2}{2b+3b}=\frac{238b}{5b}=47,6g/mol\)
\(\rightarrow d_{A/B}=\frac{17}{47,6}=\frac{5}{14}\approx0,36\)
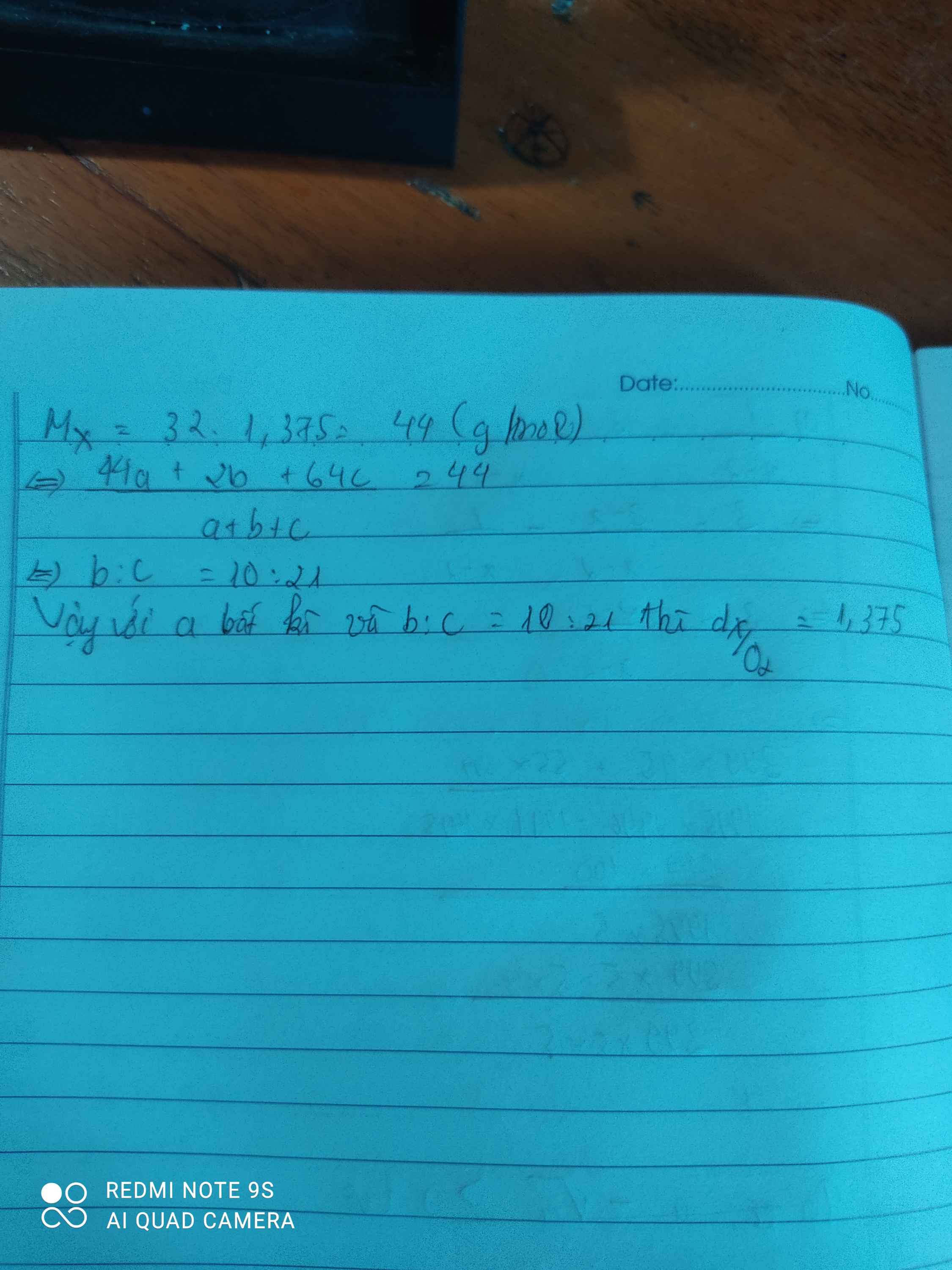
Tham khảo
:) làm thế này thì còn gì môn khtn nữa, mình ko làm được thì để người khác làm