Tính khối lượng khí oxi thu được khi nhiệt phân hoàn toàn 0,15 mol thuốc tím KMnO4?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Pthh : 2KMnO4 -t--> K2MnO4 +MnO2 + O2
0,15----------------------------->0,075(mol)
=> mO2 = 0,075.32=2,4(g)

\(V_{O_2\left(thu.được\right)}=28=0,1=2,8\left(l\right)\)
=> \(V_{O_2\left(sinh.ra\right)}=\dfrac{2,8.100}{80}=3,5\left(l\right)\)
=> \(n_{O_2\left(sinh.ra\right)}=\dfrac{3,5}{22,4}=0,15625\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3125<------------------------0,15625
=> mKMnO4 = 0,3125.158 = 49,375 (g)

\(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
Ta có : \(n_{O2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(TheoPTHH:n_{KMnO4}=2n_{O2}=0,2\left(mol\right)\)
\(\Rightarrow m=n.M=31,6\left(g\right)\)

a.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(PTHH:2KMnO_4\underrightarrow{np}K_2MnO_4+MnO_2+O_2\)
2 1 1 1 ( mol )
0,2 0,1
\(V_{O_2}=n.22,4=0,1.22,4=2,24l\)
b.\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,2 0,1
0,1 0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n.M=0,05.232=11,6g\)

2KMnO4 --to--> MnO2 + O2 + K2MnO4
0,6 <------------------------- 0,3 (mol)
a) nO2 = V/22,4 = 6,12/22,4 ≃ 0,3 (mol)
=> mKMnO4 = n . M = 0,6 . 158 = 94,8 ( g)
b) *PT (a) thu được khí O2
3O2 + 4Al --to--> 2Al2O3
0,3 -> 0,4 (mol)
mO2 = 0,3 . 32 = 9,6 (g)
mAl = 0,4 . 27 = 10,8 (g)
Khối lượng chất rắn cần tìm:
mAl2O3 = mO2 + mAl = 9,6 + 10,8 = 20,4 (g)

$n_{Al} = \dfrac{0,54}{27} = 0,02(mol)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
Theo PTHH :
$n_{O_2} = \dfrac{3}{4}n_{Al} = 0,015(mol)$
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$n_{KMnO_4\ pư} = 2n_{O_2} = 0,03(mol)$
$n_{KMnO_4\ đã\ dùng} = 0,03 : 80\% = 0,0375(mol)$
$m_{KMnO_4} = 0,0375.158 = 5,925(gam)$

a)nO2=\(\dfrac{3.36}{22.4}\)=0,15(mol)
2KMnO4(to)→K2MnO4+MnO2+O2
Theo PT: nKMnO4=2nO2=0,3(mol)
→m=mKMnO4=0,3.158=47,4(g)
b)nH2=\(\dfrac{8.96}{22.4}\)=0,4(mol)
2H2+O2(to)→2H2O
Vì \(\dfrac{nH_2}{2}\)<nO2→O2nH2 dư
Theo PT: nH2O=nH2=0,4(mol)
→mH2O=0,4.18=7,2(g)

PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a. Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12\left(l\right)\)
b. PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có: \(\dfrac{1}{n_{O_2}}=\dfrac{1}{0,05}\)
\(\dfrac{1}{n_{Fe}}=\dfrac{1}{0,1}\)
\(\Rightarrow\dfrac{1}{n_{O_2}}>\dfrac{1}{n_{Fe}}\)
Vậy Fe dư
Theo PTHH: \(n_{Fe_3O_4}=\dfrac{0,1.1}{3}=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,73g\)

Theo định luật bảo toàn khối lượng ta có: m O 2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%
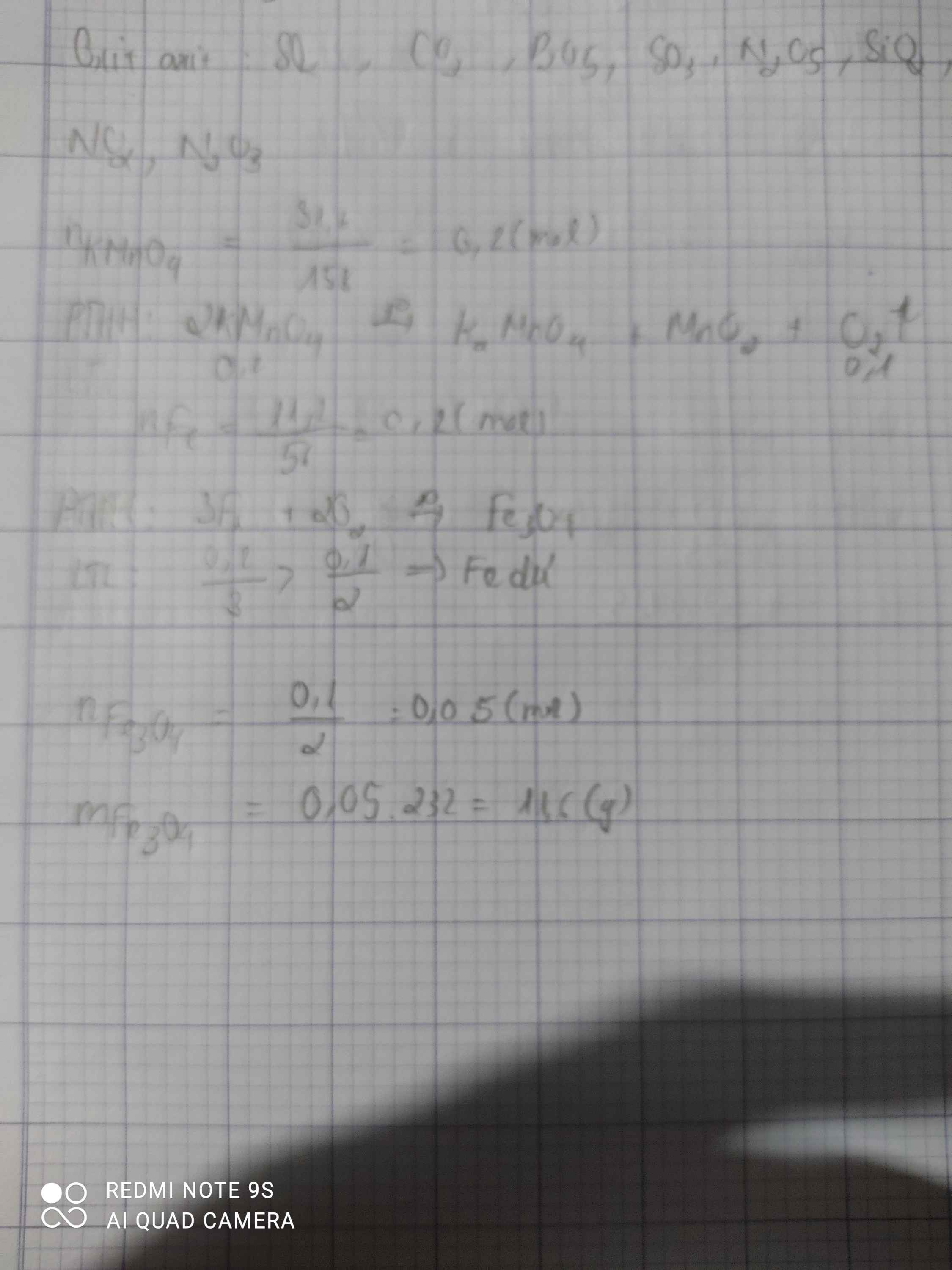
2KMnO4-to>K2MnO4+MnO2+O2
0,15------------------------------------0,075 mol
=>vO2=0,075.22,4=1,68l