Thêm 3,0 gam MnO2 vào 200gam hỗn hợp X gồm KCl và KClO3, trộn kĩ hỗn hợp thu được và đun nóng đến phản ứng xảy ra hoàn toàn (khối lượng hỗn hợp không đổi) thu được chất rắn Y cân nặng 145,4gam. Xác định thành phần phần trăm theo khối lượng của các muối trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A.
Bảo toàn khối lượng: mO2 = 3 + 197 – 152 = 48 (gam)
nO2 = 1,5 (mol)
2KClO3 → 2KCl + 3O2 ↑
⇒ mKCl = 197 – 1.122,5 = 74,5 (gam)

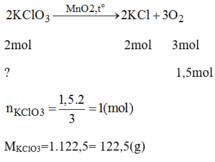
Khối lượng oxi thoát ra: m O 2 = 197 + 3 – 152 = 48(g)
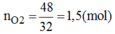
PTHH của phản ứng:
Khối lượng của KCl trong hỗn hợp ban đầu:
m K C l = 197-122,5 = 74,5(g)
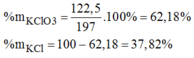

Đáp án C
MnO2 là chất xúc tác nên sử dụng định luật bảo toàn khối lượng ta được:
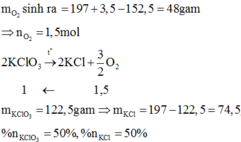

KMnO4-----to----> K2MnO4 + MnO2 + O2
2 KClO3 -----to-----> 2 KCl + 3O2
Rắn B gồm K2MnO4 + MnO2 và KCl
Khi cho B vào dd H2SO4 khí tạo thành là khí Cl2 và số mol Cl2 = 0,015 mol
Vì bảo toàn số nguyên tử Cl => số mol KCl = 0,03
Khối lượng KCl = 0,03.74,5 = 2,235
khối lượng hỗn hợp A = 2,235.100/75,62 = 2,956 gam
P/ư:
2H2SO4 +2 KCl + MnO2 -----> K2SO4 + MnSO4 + Cl2 +2 H2O
4H2SO4 +4 KCl + K2MnO4 -----> 3K2SO4 + MnSO4 + 2Cl2 +4 H2O
Đây bạn nhé !!


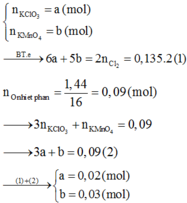
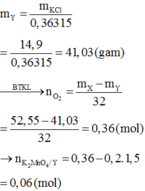
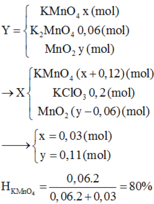
mgiảm = mO2 (sinh ra) = 200 + 3 - 145,4 = 57,6 (g)
\(\rightarrow n_{O_2}=\dfrac{57,6}{32}=1,8\left(mol\right)\)
PTHH: 2KClO3 --to, MnO2--> 2KCl + 3O2
1,2 1,8
\(\rightarrow m_{KClO_3}=1,2.122,5=147\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{147}{200}=73,5\%\\\%m_{KCl}=100\%-73,5\%=26,5\%\end{matrix}\right.\)
Khối lượng oxi thoát ra: 197 + 3 – 152 = 48(g)
Số mol O2=4832=1,5(mol)O2=4832=1,5(mol)
Phương trình hóa học của phản ứng :
2KClO3MnO2,to⟶2KCl+3O22KClO3⟶MnO2,to2KCl+3O2
2 mol 3 mol
1,5×23=1mol1,5×23=1mol ←← 1,5 mol
Khối lượng KClO3KClO3 trong hỗn hợp : 1 x 122,5 =122,5 (g)Khối lượng KCl trong hỗn hợp ban đầu: 197 – 122,5 = 74,5(g)→%mKClO3=62,18%;%mKCl=37,82%→%mKClO3=62,18%;%mKCl=37,82%