Cho 6,72 lít hỗn hợp c 2 H 6 CH4 tác dụng với 200 ml brom 1 mol a. Tính thể tích mỗi khí trong hỗn hợp ban đầu b. Tính khối lượng dung dịch thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
nBr2 = 0,2.0,2 = 0,04 (mol)
nCaCO3 = \(\dfrac{10}{100}=0,1\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,04<--0,04---->0,04
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,04--------------->0,08
CH4 + 2O2 --to--> CO2 + 2H2O
0,02<-------------0,02
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,1<------0,1
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,02}{0,02+0,04}.100\%=33,33\%\\\%V_{C_2H_4}=\dfrac{0,04}{0,02+0,04}.100\%=66,67\%\end{matrix}\right.\)
b) mC2H4Br2 = 0,04.188 = 7,52 (g)

a) Các phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
C2H2 + Ag2O → C2Ag2 + H2O
Hay
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
b) Gọi a, b, c lần lượt là số mol của CH4, C2H4, C2H2 trong 4,3gam hỗn hợp T.
– Số mol Br2 = 0,15 (mol); số mol kết tủa = số mol C2H2 = 0,075 (mol); số mol T = 0,3 (mol). Do đó nT = 4nC2H2
– Ta có hệ phương trình:
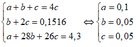
– Suy ra % thể tích mỗi khí trong T:
%VCH4 = 50%; %VC2H2 = %VC2H4 = 25%

Ta có: \(n_{Br_2}=\dfrac{1,6}{160}=0,01\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,01\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\dfrac{0,01.22,4}{0,5}.100\%=44,8\%\)
\(\Rightarrow\%V_{CH_4}=100-44,8=55,2\%\)

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\Rightarrow24x+65y=11,3\left(1\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\Rightarrow x+y=0,3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2mol\\y=0,1mol\end{matrix}\right.\)
a)\(\%m_{Mg}=\dfrac{0,2\cdot24}{11,3}\cdot100\%=42,48\%\)
\(\%m_{Zn}=100\%-42,48\%=57,52\%\)
b)\(n_{HCl}=2\left(n_{Mg}+n_{Zn}\right)=2\cdot\left(0,2+0,1\right)=0,6mol\)
\(C_{M_{HCl}}=\dfrac{0,6}{0,2}=3M\)

a.\(n_{Br_2}=\dfrac{48}{160}=0,3mol\)
\(n_{hh}=\dfrac{7,84}{22,4}=0,35mol\)
\(C_2B_2+2Br_2\rightarrow C_2H_2Br_4\)
0,15 0,3 ( mol )
\(\%V_{C_2H_2}=\dfrac{0,15}{0,35},100=42,85\%\)
\(\%V_{CH_4}=100\%-42,85\%=57,15\%\)
b.\(n_{CH_4}=0,35-0,15=0,2mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,4 ( mol )
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
0,15 0,15 ( mol )
\(m_{H_2O}=\left(0,4+0,15\right).18=9,9g\)

a)
Khí thoát ra: CH4
\(\%V_{CH_4} = \dfrac{6,72}{16,8}.100\% = 40\%\\ \%V_{C_2H_4} = 100\% - 40\% = 60\%\)
b)
\(n_{C_2H_4} = \dfrac{16,8-6,72}{22,4} = 0,45(mol)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ n_{Br_2} = n_{C_2H_4} = 0,45(mol)\\ \Rightarrow C_{M_{Br_2}} = \dfrac{0,45}{2} = 0,225M\\ c) n_{C_2H_4Br_2} = n_{C_2H_4} = 0,45(mol)\\ \Rightarrow n_{C_2H_4Br_2} = 0,45.188 = 84,6(gam)\)
Bài 4:
a) n(hỗn hợp khí)= 16,8/22,4=0,75(mol)
- Khí thoát ra là khí CH4.
=> nCH4=6,72/22,4=0,3(mol)
nC2H4=0,75-0,3=0,45(mol)
- Số mol tỉ lệ thuận với thể tích.
%V(CH4)=%nCH4= (0,3/0,75).100=40%
=> %V(C2H4)=100% - 40%=60%
b) PTHH: C2H4 + Br2 -> C2H4Br2
nC2H4Br2= nBr2=nC2H4=0,45(mol)
=>VddBr2= 0,45/2=0,225(l)
c) mC2H4Br2=0,45. 188= 84,6(g)

Tham khảo
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2----------------------------------------------0,3
nH2=6,72\22,4=0,3 mol
=>mAl=0,2.27=5,4g

Bạn check lại đề cho mình, cả CH4 và C2H6 đều ko làm mất màu Br2 á:)