Đốt cháy hoàn toàn 4,2g Hidrocacbon A thu được 6,72 lít khí CO2 (đktc) và hơi nước. Biết A có tỉ khối Hidro là 21. Xác định công thức phân tử của Hidrocacbon.
Giúp em với ạ :<
Em cảm ơn nhiều :3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCO2= 0,3(mol) -> nC=0,3(mol)
nH2O =0,25(mol) -> nH=0,5(mol)
mC+mH=0,3.12+0,5.1=4,1(g) < 5,7(g)
=>mO=5,7-4,1=1,6(g) -> nO=0,1(mol)
Gọi CTTQ X: CxHyOz (x,y,z: nguyên, dương)
Ta có: x:y:z= 0,3:0,5:1= 3:5:1
=> CT ĐG nhất X: C3H5O.
b) M(X)=57.2=114(g/mol)
Mà: M(X)=M(C3H5O)a= 57a
<=>114=57a
<=>a=2
=>CTPT X : C6H10O2

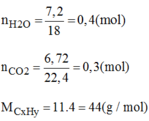
Phương trình hóa học của phản ứng:
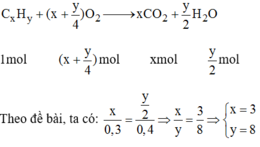
Công thức phân tử của H.C có dạng C 3 H 8 n
→ (12.3 + 1.8).n= 44 → n=1
Vậy công thức phân tử là C 3 H 8

\(n_C=n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_H=2n_{H_2O}=2.\dfrac{5,4}{18}=0,6\left(g\right)\\ n_{C_xH_y}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ CTPT:C_xH_y\\ x:y=0,3:0,6=1:2\\ \Rightarrow\left(CH_2\right)_n=\dfrac{0,3.12+0,6}{0,1}=42\left(\dfrac{g}{mol}\right)\\ \Rightarrow n=3\\ CTPT:C_3H_6\)

Bn check lại đề chứ mình nghĩ VCO2 = 0,672
\(n_{CO_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_{H_2O}=\dfrac{0,54}{18}=0,03\left(mol\right)\)
Bảo toàn C: nC(Y) = 0,03 (mol)
Bảo toàn H: nH(Y) = 2.0,03 = 0,06 (mol)
=> \(n_O=\dfrac{0,74-0,03.12-0,06}{16}=0,02\left(mol\right)\)
nC : nH : nO = 0,03 : 0,06 : 0,02 = 3:6:2
=> CTHH: (C3H6O2)n
Mà M = 2.37 = 74
=> n = 1
=> CTHH: C3H6O2

Ta có: \(d_{A/H_2}=100\)
\(\Rightarrow M_A=100.2=200\left(g/mol\right)\)
\(\Rightarrow n_A=\dfrac{2}{200}=0,01\left(mol\right)\)
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\Rightarrow n_C=0,1\left(mol\right)\)
⇒ Số nguyên tử C trong A là: \(\dfrac{0,1}{0,01}=10\)
\(n_{H_2O}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\Rightarrow n_H=0,08.2=0,16\left(mol\right)\)
⇒ Số nguyên tử H trong A là: \(\dfrac{0,16}{0,01}=16\)
Giả sử n là số nguyên tử O có trong A.
Ta có: 10.12 + 16 + n.16 = 200
⇒ n = 4
Vậy: CTPT của A là C10H16O4.
Bạn tham khảo nhé!
Bảo toàn nguyên tố với C,H :
\(n_C = n_{CO_2} = \dfrac{4,4}{44}= 0,1(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{1,792}{22,4} = 0,16(mol)\)
Mà :
\(m_O = m_A - m_C - m_H = 2 - 0,1.12 - 0,16 = 0,64(gam)\\ \Rightarrow n_O = \dfrac{0,64}{16} = 0,04(mol)\)
Ta có :
\(n_C: n_H : n_O = 0,1 :0,16 : 0,04 = 5 : 8 : 2\)
Vậy CTPT của A là : \((C_5H_8O_2)_n\)
Mà :
\(M_A = (12.5+8+16.2)n = M_{H_2}.100 = 200(đvC)\\ \Rightarrow n = 2\)
Vậy CTPT của A : \(C_{10}H_{16}O_4\)

Thông thường khi đề bài cho số mol O2 cần để đốt cháy thì chắc chắn ta sẽ phải sử dụng hoặc định luật bảo khối lượng, hoặc bảo toàn nguyên tố Oxi.
Quay trở lại bài toán này, ta thấy đề cho cần dùng 1,904 lít O2, không cho khối lượng CO2 và H2O mà chỉ cho tỉ lệ thể tích (tỉ lệ số mol), do đó nhận ra được nếu ta sử dụng phương pháp bảo toàn khối lượng ta sẽ tính được số mol CO2 và số mol H2O, từ đó tính được số mol O trong A. Tiếp theo đó ta sẽ xác định công thức đơn giản nhất để tìm ra công thức phân tử.
Có: n O 2 = 1 , 904 22 , 4 = 0 , 085 ( m o l ) ⇒ m O 2 = 0 , 085 . 32 = 2 , 72 ( g a m )
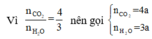
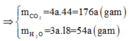
Sơ đồ phản ứng: A + O2 ⇒ CO2 + H2O
Áp dụng định luật bảo toàn khối lượng ta có: m A + m O 2 = m C O 2 + m H 2 O
Hay 1,88 + 2,72 = 176a + 54a ⟺ a = 0,02
⇒ 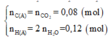
![]()
![]()
Vì C : H : O = nC : nH : nO =0,08 : 0,12 : 0,05 = 8 : 12 : 5
Nên công thức đơn giản nhất của A là C8H12O5.
Khi đó công thức phân tử của A có dạng (C8H12O5)n
Mà MA < 7Mkhôngkhí nên 188n < 7.29 ⇒ n < 1,08 ⇒ n = l
Do đó công thức phân tử của A là C8H12O5.
Đáp án A.

C3H6
Giải thích các bước giải:
A + O2 ---> CO2 + H2O
nCO2=6,72 /22,4=0,3 mol
nH2O=5,4/18=0,3 mol
-> A chứa 0,3 mol C và 0,6 mol H
-> C : H=0,3:0,6=1:2 -> A có dạng (CH2)n
Ta có: dA/O2=1,3125 -> mA=32.1,3125=42 -> 14n=42 -> n=3
-> A là C3H6

Câu 1:
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
Gọi CTPT cần tìm là CxHy.
⇒ x:y = 0,3:0,6 = 1:2
→ CTPT cần tìm có dạng (CH2)n
Mà: M = 1,3125.32 = 42 (g/mol)
\(\Rightarrow n=\dfrac{42}{12+1.2}=3\)
Vậy: CTPT đó là C3H6.
Câu 2:
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\Rightarrow n_H=0,15.2=0,3\left(mol\right)\)
Có: mC + mH = 0,15.12 + 0,3.1 = 2,1 (g) < 4,5 (g)
→ Chất cần tìm gồm: C, H và O.
⇒ mO = 4,5 - 2,1 = 2,4 (g) \(\Rightarrow n_O=\dfrac{2,4}{16}=0,15\left(mol\right)\)
Gọi: CTPT cần tìm là CxHyOz.
⇒ x:y:z = 0,15:0,3:0,15 = 1:2:1
→ CTPT cần tìm có dạng (CH2O)n
\(\Rightarrow n=\dfrac{60}{12+1.2+16}=2\)
Vậy: CTPT đó là C2H4O2
Đặt công thức phân tử A là CxHy ( x,y ∈ N*)
nCO2 = 6,72/22,4=0,3(mol)
=> mCO2 = 0,3 . 44 = 13,2 (g)
=> mC = 3.13,2/11=3,6(g)
mH = 5,49=0,6(g)
ta có tỉ lệ :
12x/3,6=y/0,6=42/4,2
=> x=3 , y = 6
=> CTPT : C3H6
C3H6 + Br2 -> C3H6Br2
\(n_C=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_H=\dfrac{4,2-0,3.12}{1}=0,6\left(mol\right)\)
\(CTPT:C_xH_y\\ \rightarrow x:y=0,3:0,6=1:2\\ \rightarrow\left(CH_2\right)_n=21.2=42\\ \rightarrow n=2\\ CTPT:C_3H_6\)