Dẫn V lít SO2(đktc) vào dd NaOH thu được 6,3 g NA2SO3 và 1 g NaOH dư . Tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaHSO_3}=\dfrac{10,4}{104}=0,1\left(mol\right)\\ n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)\)
PTHH:
\(NaOH+SO_2\rightarrow NaHSO_3\)
0,1 0,1 0,1
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
0,2 0,1 0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\C_{MNaOH}=\dfrac{0,1+0,2}{0,4}=0,75M\end{matrix}\right.\)

\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
Cho X vào dung dịch `H_2SO_4` loãng:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,025<-----------------------0,025
a. \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,025.100\%}{11,8}=11,86\%\\\%m_{Cu}=\dfrac{\left(11,8-0,025.56\right).100\%}{11,8}=88,14\%\end{matrix}\right.\)
b. \(n_{Cu}=\dfrac{11,8-0,025.56}{64}=0,1625\left(mol\right)\)
Cũng lượng X trên cho vào dung dịch `H_2SO_4` đặc nóng:
Giả sử Fe tác dụng hết với dung dịch \(H_2SO_{4.đn}\)
\(2Fe+6H_2SO_{4.đn}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,025----------------------------------->0,0375
\(Cu+2H_2SO_{4.đn}\rightarrow CuSO_4+SO_2+2H_2O\)
0,1625--------------------------->0,1625
\(\Sigma n_{SO_2}=0,0375+0,1625=0,2\left(mol\right)\)
Có: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Phản ứng giữa `NaOH` và `SO_2` tạo muối axit trước (tỉ lệ 1:1)
\(SO_2+NaOH\rightarrow NaHSO_3\)
0,2---->0,2------->0,2
Xét \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\Rightarrow\) NaOH dư.
\(n_{NaOH.dư}=0,25-0,2=0,05\left(mol\right)\)
\(NaOH+NaHSO_3\rightarrow Na_2SO_3+H_2O\)
0,05----->0,05---------->0,05
Xét \(\dfrac{0,05}{1}< \dfrac{0,2}{1}\Rightarrow NaHSO_3.dư\)
Sau phản ứng thu được: \(\left\{{}\begin{matrix}n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\\n_{Na_2SO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,15.104+0,05.126=21,9=m_{muối.thu.được.theo.đề}\)
=> Giả sử đúng.
\(\Rightarrow V=V_{SO_2}=0,2.22,4=4,48\left(l\right)\)

nBa(OH)2= 0,15 (mol)
nNaOH= 0,3 (mol)
nBaCO3 = 0,1 (mol)
Các pt xảy ra theo thứ tự:
Ba(OH)2 + CO2 \(\rightarrow\) BaCO3 + H2O (1)
2NaOH + CO2 \(\rightarrow\) Na2CO3 + H2O (2)
nếu CO2 dư:
Na2CO3 + CO2 + H2O \(\rightarrow\) 2NaHCO3 (3)
BaCO3 + CO2 + H2O \(\rightarrow\) Ba(HCO3)2 (4)
+ TH1: CO2 pư vừa đủ với dd hh bazơ
Theo pt(1) nBaCO3 = nBa(OH)2 = 0,15 \(\ne\) 0,1 (mol) (loại)
+ TH2: CO2 pư thiếu so với dd hh bazơ \(\Rightarrow\) xảy ra pt (1)
Theo pt(1) nCO2 = nBaCO3= 0,1 (mol)
VCO2= 0,1 . 22,4 = 2,24 (l)
+ TH3: CO2 pư dư so với dd hh bazơ \(\Rightarrow\) xảy ra pt(1), (2), (3), (4)
Ba(OH)2 + CO2 \(\rightarrow\) BaCO3 \(\downarrow\) + H2O
0,15 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15 (mol)
2NaOH + CO2 \(\rightarrow\) Na2CO3 + H2O
0,3 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15 (mol)
Na2CO3 + CO2 + H2O \(\rightarrow\) 2NaHCO3
0,15 \(\rightarrow\) 0,15 (mol)
BaCO3 + CO2 + H2O \(\rightarrow\) Ba(HCO3)2
(0,15 - 0,1) \(\rightarrow\) 0,05 (mol)
VCO2 = (0,15 + 0,15 + 0,15 + 0,05).22,4= 11,2 (l)
nBa(OH)2= 0,15 (mol)
nNaOH= 0,3 (mol)
nBaCO3 = 0,1 (mol)
Các pt xảy ra theo thứ tự:
Ba(OH)2 + CO2 →→ BaCO3 + H2O (1)
2NaOH + CO2 →→ Na2CO3 + H2O (2)
nếu CO2 dư:
Na2CO3 + CO2 + H2O →→ 2NaHCO3 (3)
BaCO3 + CO2 + H2O →→ Ba(HCO3)2 (4)
+ TH1: CO2 pư vừa đủ với dd hh bazơ
Theo pt(1) nBaCO3 = nBa(OH)2 = 0,15 ≠≠ 0,1 (mol) (loại)
+ TH2: CO2 pư thiếu so với dd hh bazơ ⇒⇒ xảy ra pt (1)
Theo pt(1) nCO2 = nBaCO3= 0,1 (mol)
VCO2= 0,1 . 22,4 = 2,24 (l)
+ TH3: CO2 pư dư so với dd hh bazơ ⇒⇒ xảy ra pt(1), (2), (3), (4)
Ba(OH)2 + CO2 →→ BaCO3 ↓↓ + H2O
0,15 →→ 0,15 →→ 0,15 (mol)
2NaOH + CO2 →→ Na2CO3 + H2O
0,3 →→ 0,15 →→ 0,15 (mol)
Na2CO3 + CO2 + H2O →→ 2NaHCO3
0,15 →→ 0,15 (mol)
BaCO3 + CO2 + H2O →→ Ba(HCO3)2
(0,15 - 0,1) →→ 0,05 (mol)
VCO2 = (0,15 + 0,15 + 0,15 + 0,05).22,4= 11,2 (l)
Dẫn V lít khí \(SO_2\) (đktc) vào dung dịch NaOH, thu được 6,3 g \(Na_2SO_3\)và 1 g NaOH dư. Tính V.

ta có : \(n_{Na_2SO_3}=n_{SO_2}=0,05\)
\(\Rightarrow V_{SO_2}=0,05.22,4=1,12\left(l\right)\)

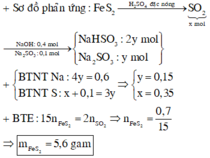
\(n_{SO2}=0,25\left(mol\right);n_{NaOH}=0,2\left(mol\right)\)
Đặt a, b là hỗn hợp muối gồm NaHSO3 , Na2SO3
\(\Rightarrow m_{muoi}=104a+126b=43,8\left(1\right)\)
Áp dụng bảo toàn nguyên tố S:
\(n_{SO2}+n_{Na2SO3_{truoc.pu}}=n_{NaHSO3}+n_{Na2SO3_{sau.pu}}\)
\(=0,25+0,2x=a+b\left(2\right)\)
Áp dụng bảo toàn nguyên tố Na:
\(n_{NaOH}+2.n_{Na2SO3_{truoc.pu}}=n_{NaHSO3}+2.n_{Na2SO3_{sau.pu}}\)
\(\Rightarrow0,2+2.0,2x=a+2b\left(3\right)\)
Từ (1) , (2) , (3) \(\Rightarrow\left\{{}\begin{matrix}a=0,3\left(mol\right)\\b=0,1\left(mol\right)\\x=0,75\left(mol\right)\end{matrix}\right.\)

Khi cho hỗn hợp khí vào dung dịch NaOH thì chỉ có khí CO2 phản ứng với NaOH ( Chú ý đề thiếu, NaOH phải dư nhé!)
\(CO_2+2NaOH--->Na_2CO_3+H_2O\) (1)
0,075 <-----------------------------------------0,075 (mol)
Dung dịch X là Na2CO3 .
\(Na_2CO_3+BaCl_2--->BaCO_3\downarrow+2NaCl\)(2)
0,015 <----------------------------------------0,015 (mol)
Kết tủa là BaCO3, dung dịch Y gồm NaCl và có thể là BaCl2 dư hoặc Na2CO3 dư
Cho dung dịch Y vào Ba(OH)2 xuất hiện kết tủa nên dung dịch Y sẽ là có Na2CO3 dư.
\(Na_2CO_3+Ba\left(OH\right)_2--->BaCO_3\downarrow+2NaOH\) (3)
0, 06 <----------------------------------------- 0,06 (mol)
Ta có: \(n_{BaCO_3\left(2\right)}=\frac{2,955}{137+12+16.3}=0,015\left(mol\right)\)
\(n_{BaCO_3\left(3\right)}=\frac{11,82}{137+12+16.3}=0,06\left(mol\right)\)
=> \(n_{Na_2CO_3\left(X\right)}=0,015+0,06=0,075\left(mol\right)\)
=> \(n_{CO_2}=0,075\left(mol\right)\)=> \(V_{CO_2}=0,075.22,4=1,68\left(l\right)\)
=> \(\%V_{CO_2}=\frac{1,68}{6}.100\%=28\%\)

\(n_{SO_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(n_{NaOH}=0.5\cdot1.2=0.6\left(mol\right)\)
\(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0.6}{0.4}=1.5\)
\(n_{Na_2SO_3}=a\left(mol\right),n_{NaHSO_3}=b\left(mol\right)\)
\(\left\{{}\begin{matrix}2a+b=0.6\\a+b=0.4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0.2\\b=0.2\end{matrix}\right.\)
\(C_{M_{Na_2SO_3}}=C_{M_{NaHSO_3}}=\dfrac{0.2}{0.5}=0.4\left(M\right)\)
\(\Rightarrow A\)
- Gọi số mol Na2SO3 và NaHSO3 tạo ra là a, b mol .
BTS : a + b = nSO2 = 0,4
BTĐT : 2a + b = 0,6 .
=> a = b = 0,2 mol
=> CM của Na2SO3 và NaHSO3 lần lượt là : 0,4M và 0,4M
Vậy ....
2NaOH + SO2 ---> Na2SO3 + H2O
n Na2SO3 =\(\dfrac{6,3}{126}\) =0,05 mol => nSO2 = nNaSO3 =0,05 mol
nNaOH = \(\dfrac{1}{40}\)=0,025 mol
=> VSO2= 0,05 *22,4 = 1,12 l
\(2NaOH + SO_2 \to Na_2SO_3 + H_2O\\ n_{SO_2} = n_{Na_2SO_3} = \dfrac{6,3}{126} = 0,05(mol)\\ V_{SO_2} = 0,05.22,4 = 1,12(lít)\)