Cho 24,8g hỗn hợp Cu2S và FeS có cùng số mol, tác dụng với H2SO4 đặc dư đun nóng thấy thoát ra V lít khí SO2 (đktc). a,Tính V và khối lượng muối thu được trong dung dịch sau phản ứng
b, tính số mol axit đã tham gia phản ứng
c, cho dung dịch sau phản ứng với KOH dư thu được m g hỗn hợp 2 chất rắn , nung chất rắn tới khối lượng không đổi chỉ thấy hỗn hợp 2 oxit nặng a gam. Tính a và m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{Cu_2S}=n_{FeS}=0,1(mol)$
Bảo toàn e ta có: $n_{SO_2}=0,95(mol)\Rightarrow V=21,28(l)$
Bảo toàn nguyên tố Cu và Fe ta có: $n_{CuSO_4}=0,2(mol);n_{Fe_2(SO_4)_3}=0,05(mol)$
$\Rightarrow m_{muoi}=52(g)$
Bảo toàn S ta có: $n_{H_2SO_4}=1,1(mol)$
Bảo toàn Cu và Fe ta có: $n_{CuO}=0,2(mol);n_{Fe_2O_3}=0,05(mol)$
$\Rightarrow a=36(g)$
Theo gt ta có: nCu2S=nFeS=0,1(mol)nCu2S=nFeS=0,1(mol)
Bảo toàn e ta có: nSO2=0,95(mol)⇒V=21,28(l)nSO2=0,95(mol)⇒V=21,28(l)
Bảo toàn nguyên tố Cu và Fe ta có: nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)
⇒mmuoi=52(g)⇒mmuoi=52(g)
Bảo toàn S ta có: nH2SO4=1,1(mol)nH2SO4=1,1(mol)
Bảo toàn Cu và Fe ta có: nCuO=0,2(mol);nFe2O3=0,05(mol)nCuO=0,2(mol);nFe2O3=0,05(mol)
⇒a=36(g
ok nha

\(n_{Fe}=a\left(mol\right),n_{FeO}=b\left(mol\right)\)
\(m_X=56a+72b=12.8\left(g\right)\)
\(n_{H_2}=n_{Fe}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\Rightarrow a=0.1\)
\(b=\dfrac{12.8-56\cdot0.1}{72}=0.1\left(mol\right)\)
\(BTe:\)
\(3n_{Fe}+n_{FeO}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=\dfrac{3\cdot0.1+0.1}{2}=0.2\left(mol\right)\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(\)

$n_{SO_2}=\dfrac{2,24}{22,4}=0,1(mol)$
Quy hỗn hợp về $Fe:x(mol),O:y(mol)$
$\to 56x+16y=30,4(1)$
Bảo toàn e: $3n_{Fe}=2n_O+2n_{SO_2}$
$\to 3x=2y+0,2(2)$
Từ $(1)(2)\to x=0,4(mol);y=0,5(mol)$
Bảo toàn Fe: $n_{Fe_2(SO_4)_3}=0,5x=0,2(mol)$
$\to m_X=0,2.400=80(g)$

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)


Số mol S O 2 = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
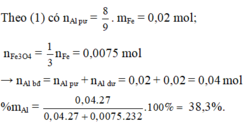
⇒ Chọn C.

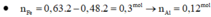
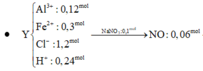
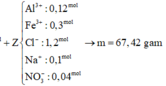
\(n_{Cu_2S}=n_{FeS}=a\left(mol\right)\\ 160a+88a=24,8\left(g\right)\\ \rightarrow n_{Cu_2S}=n_{FeS}=0,1\left(mol\right)\)
PTHH:
Cu2S + 6H2SO4 ---> 2CuSO4 + 5SO2 + 6H2O
0,1 ------> 0,6 ----------> 0,2 ------> 0,5 ------> 0,6
2FeS + 10H2SO4 ---> Fe2(SO4)3 + 9SO2 + 10H2O
0,1 ------> 0,5 -----------> 0,05 --------> 0,45 ---> 0,5
\(\rightarrow\left\{{}\begin{matrix}V_{SO_2}=\left(0,5+0,45\right).22,4=21,28\left(l\right)\\n_{H_2SO_4}=0,5+0,6=1,1\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2(SO4)3 + 6KOH ---> 2Fe(OH)3 + 3K2SO4
0,05 ------------------------> 0,1
CuSO4 + 2KOH ---> Cu(OH)2 + K2SO4
0,2 -----------------------> 0,2
2Fe(OH)3 --to--> Fe2O3 + 3H2O
0,1 ------------------> 0,05
Cu(OH)2 --to--> CuO + H2O
0,2 ----------------> 0,2
\(\rightarrow\left\{{}\begin{matrix}m=107.0,1+98.0,2=20,5\left(g\right)\\a=0,05.160+0,2.80=24\left(g\right)\end{matrix}\right.\)