Tỉ khối của hỗn hợp khí A gồm khí metan (CH4) và Oxi đối với khí Hidro là 14,4. Bật tia lửa điện để đốt cháy hoàn toàn khí metan thì thu được hỗn hợp khí B và hơi nước. Tính tỉ khối của B so với A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi số mol H2, CH4 là a, b
=> \(a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(M_X=\dfrac{2a+16b}{a+b}=0,325.32=10,4\)
=> a = 0,2 ; b = 0,3
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,5}.100\%=40\%\\\%V_{CH_4}=\dfrac{0,3}{0,5}.100\%=60\%\end{matrix}\right.\)
b) \(n_{O_2}=\dfrac{32}{32}=1\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,3--->0,6------->0,3
2H2 + O2 --to--> 2H2O
0,2-->0,1
=> \(\left\{{}\begin{matrix}V_{CO_2}=0,3.22,4=6,72\left(l\right)\\V_{O_2\left(dư\right)}=\left(1-0,6-0,1\right).22,4=6,72\left(l\right)\end{matrix}\right.\)

Bài 2:
a) Vì khối lượng mol của N2 và CO đều bằng 28 và lớn hơn khối lượng mol của khí metan CH4 (28>16)
=> \(d_{\dfrac{hhX}{CH_4}}=\dfrac{28}{16}=1,75\)
Hỗn hợp X nhẹ hơn không khí (28<29)
b)
\(M_{C_2H_4}=M_{N_2}=M_{CO}=28\left(\dfrac{g}{mol}\right)\\ \rightarrow M_{hhY}=28\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{Y}{H_2}}=\dfrac{28}{2}=14\)
c) \(\%V_{NO}=100\%-\left(30\%+30\%\right)=40\%\\ \rightarrow\%n_{CH_4}=40\%\\ Vì:\%m_{CH_4}=22,377\%\\ Nên:\dfrac{30\%.16}{40\%.30+30\%.16+30\%.\left(x.14+16\right)}=22,377\%\\ \Leftrightarrow x=-0,03\)
Sao lại âm ta, để xíu anh xem lại như nào nhé.
Bài 1:
\(a.\\ d_{\dfrac{SO_2}{O_2}}=\dfrac{64}{32}=2\\ d_{\dfrac{SO_2}{N_2}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{SO_3}}=\dfrac{64}{80}=0,8\\ d_{\dfrac{SO_2}{CO}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{N_2O}}=\dfrac{64}{44}=\dfrac{16}{11}\\ d_{\dfrac{SO_2}{NO_2}}=\dfrac{64}{46}=\dfrac{32}{23}\\ b.M_{hhA}=\dfrac{1.64+1.32}{1+1}=48\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hhA}{O_2}}=\dfrac{48}{32}=1,5\)

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(1\right)\)
\(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,25\left(mol\right)\\n_{C_2H_2}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,25.22,4}{6,72}.100\%\approx83,33\%\\\%V_{C_2H_2}\approx16,67\%\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,625\left(mol\right)\Rightarrow m_{O_2}=0,625.32=20\left(g\right)\)

Đáp án B
Từ dB/H2 = 19 tính được nO2 : nO3 = 5 : 3
Giả sử nA =3; nB = 6,4 → nO2 = 4; nO3 = 2,4; → nO = 4.2+2,4.3=15,2
Đặt CTC 3 hidrocacbon là CxHy
CxHy + (2x+y/2)O → xCO2 + y/2H2O
Ta có 2x/y = 2,6/2,4 và 2x + y/2 = 15,2/3 → x = 26/15; y = 3,2
MA = 12.26/15 + 3,2 = 24; dA/H2 =12

Chọn C.
Đặt CTTQ của X là CxH4 Þ 12x + 4 = 28 Þ x = 2
Khi đốt cháy X thu được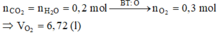

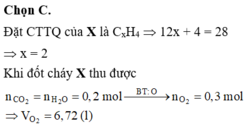
Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)