Cho cân bằng hoá học sau ở trong 1 bình kín:
\(N_{2\left(k\right)}+3H_{2\left(k\right)}⇌2NH_{3\left(k\right)}\)
Ở trạng thái cân bằng, nồng độ của các chất như sau:
\(\left[N_2\right]=1M,\left[H_2\right]=3M,\left[NH_3\right]=2M\)
a) Tính hằng số cân bằng, biết nhiệt độ không đổi.
b) Nếu thêm 1 mol N2 vào, cân bằng sẽ chuyển dịch theo chiều nào? Tính nồng độ các chất ở cân bằng mới, cho biết bình có thể tích là 1 lít.

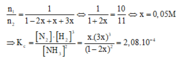
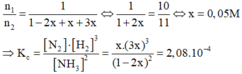
a) Hằng số cân bằng: \(K_{cb}=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\cdot\left[H_2\right]^3}=\dfrac{2^2}{1\cdot3^3}=\dfrac{4}{27}\)
b) Thêm 1 mol N2, cân bằng sẽ dịch chuyển theo chiều thuận.
\(N_2+3H_2⇌2NH_3\)
\(\left(2\right)\rightarrow3\) ..... \(\rightarrow2\)
\(x\rightarrow3x\) ..... \(\rightarrow2x\)
CB: \(2-x\rightarrow3-3x\rightarrow2+2x\)
Hằng số cân bằng luôn không đổi, nên ta có:\(K_{cb}=\dfrac{\left(2+2x\right)^2}{\left(2-x\right)\left(3-3x\right)^3}=\dfrac{4}{27}\)
\(\Leftrightarrow x\approx0,124\)
\(\Rightarrow\left\{{}\begin{matrix}\left[N_2\right]=2-0,124=1,876\left(M\right)\\\left[H_2\right]=3-3\cdot0,124=2,628\left(M\right)\\\left[NH_3\right]=2+2\cdot0,124=2,248\left(M\right)\end{matrix}\right.\).