100ml dd HCL 0,1M với dd NaOH 0.05M tính pH dd thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=0,1.0,01=0,001(mol)\\ \Rightarrow n_{OH^{-}}=0,001(mol)\\ n_{HCl}=0,03.0,2=0,006(mol)\\ \Rightarrow n_{H^{+}}=0,006(mol)\\ H^{+}+OH^{-}\to H_2O\\ 0,001<0,006\\ OH^{-} hêt; H^{+} dư\\ n_{H^{+}}=0,006-0,001=0,005(mol)\\ [H^{+}]=\frac{0,005}{0,1+0,2}=\frac{1}{60}M\\ \to pH=-log(\frac{1}{60})=1,77 \)

\(n_{HCl}=0,1.0,002=0,0002\left(mol\right)\\ n_{NaOH}=0,003.0,1=0,0003\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ Vì:\dfrac{0,0003}{1}>\dfrac{0,0002}{1}\Rightarrow NaOHdư\\ \Rightarrow pH=14+log\left[OH^-\right]=14+log\left[\dfrac{0,0001}{0,1+0,1}\right]=10,69897\)

pH=7 => trung hòa vừa đủ => nH+ =nOH,mà VH+=VOH-
=> [H+]=[OH-] => pOH=pH=2 =>pHbazo=14-2=12
nHCl=0,001 mol
H++OH−→H2OH++OH−→H2O 0,001 x
=> nH+=0,001−x=0,2.10−7nH+=0,001−x=0,2.10−7
=> x=9,9998.10^-4 => [OH-]=9,9998.10^-3
=> PH=14+log[OH]=12

\(H^++OH^-\rightarrow H_2O\)
Vì dung dịch sau phản ứng pH=12
=> OH- dư
=> \(pOH=14-12=2\)
=> \(\left[OH^-_{dư}\right]=10^{-2}M\)
=> \(n_{OH^-\left(dư\right)}=10^{-2}.0,2=2.10^{-3}\)
Đề thiếu nên không tính được CM của NaOH ban đầu
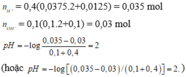
nHCl=0,1*0,1=0,01mol=nH\(^+\)=0,01 mol
nNaOH=0,1*0,05=5*10\(^{-3}\)=nOH\(^-\)=5*10\(^{-3}\)
H\(^+\) + OH\(^-\) --> H2O
trước 0,01 5*10\(^{-3}\)
p/ứ 5*10\(^{-3}\) 5*10\(^{-3}\)
sau 5*10\(^{-3}\) 0
=>-log(5*10\(^{-3}\))=2,3=>pH=2,3