Câu 5: Hoà tan hoàn toàn 11 gam hh Fe, Al bằng dd H2SO4 đặc, nóng, dư thu đựoc 10,08 lít khí SO2 (đktc). 1. Viết phương trình hóa học xảy ra 2. Tính % khối lưọng các kim loại?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nếu số lít SO2 =12.32 thì số mol sẽ là 0.55 nên Kl Cu =35.2(g).Không phù hợp yêu cầu của đề bài.

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

Gọi số mol Cu, Fe là a, b (mol)
=> 64a + 56b = 17,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
b-------------------------------->1,5b
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
a--------------------------->a
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,1.64}{17,6}.100\%=36,36\%\\\%m_{Fe}=\dfrac{0,2.56}{17,6}.100\%=63,64\%\end{matrix}\right.\)

a) PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
x___________3x______________1,5x(mol)
Fe +2 HCl -> FeCl2 + H2
y___2y____y______y(mol)
b) Ta có: m(rắn)= mCu=0,4(g)
=> m(Al, Fe)=1,5-mCu=1,5-0,4=1,1(g)
nH2= 0,04(mol)
Ta lập hpt:
\(\left\{{}\begin{matrix}27x+56y=1,1\\1,5x+y=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
=> mAl=27.0,02=0,54(g)
mFe=56.0,01=0,56(g)

Ta có: \(n_M=\dfrac{7}{M_M}\left(mol\right)\)
\(n_{SO_2}=0,1875\left(mol\right)\)
Giả sử: M có hóa trị cao nhất là a.
⇒ Số e cho là a.
Theo ĐLBT mol e, có: \(\dfrac{7a}{M_M}=0,1875.2\)
\(\Rightarrow M_M=\dfrac{56a}{3}\left(g/mol\right)\)
Với a = 1 ⇒ MM = 56/3 (loại)
a = 2 ⇒ MM = 112/3 (loại)
a = 3 ⇒ MM = 56 (nhận)
Vậy: M là Fe.
Bạn tham khảo nhé!



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3
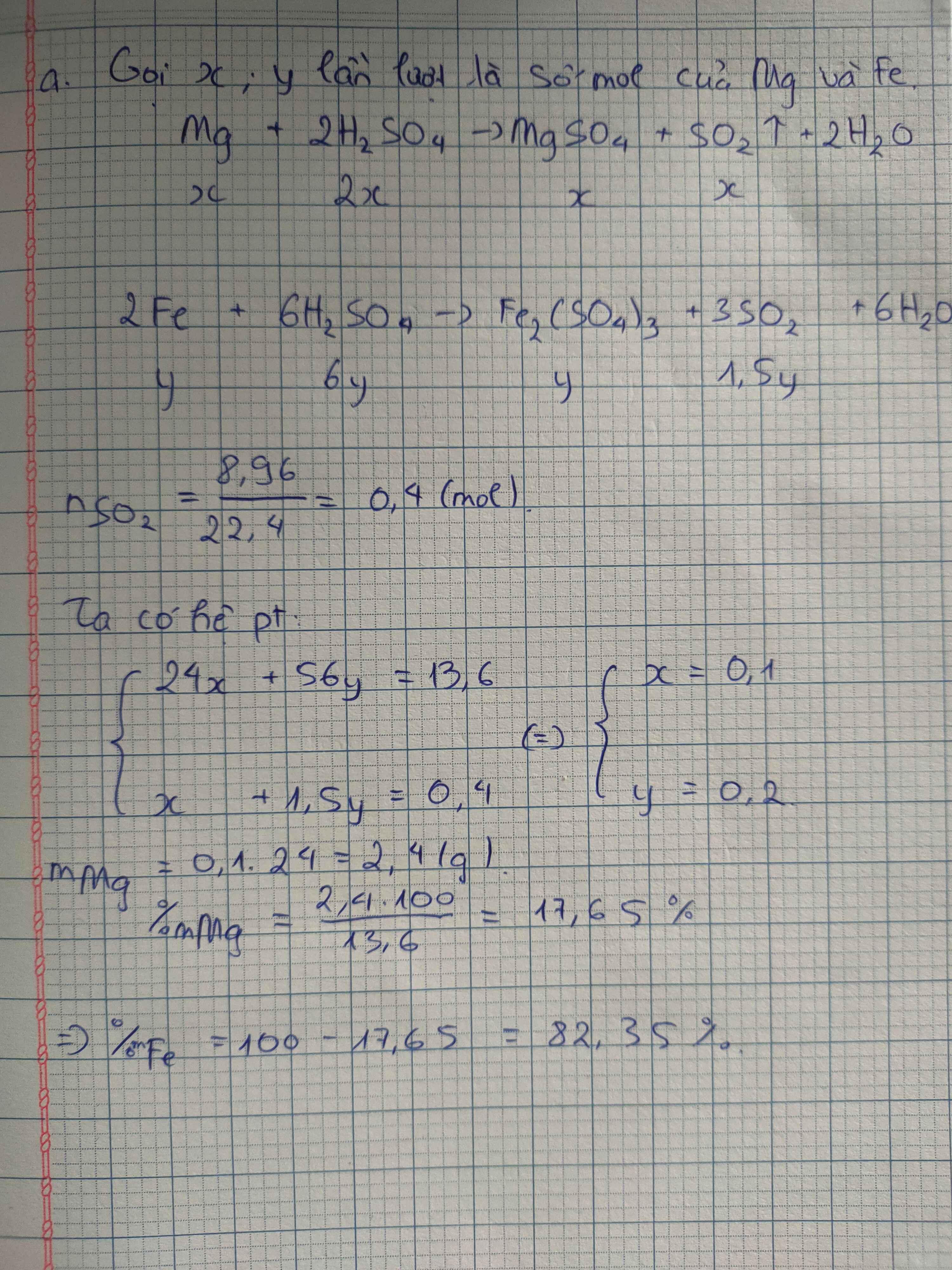



\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\\ 2Al+ 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O\\ b) n_{Fe} = a(mol) ; n_{Al} = b(mol) \Rightarrow 56a + 27b = 11(1)\\ n_{SO_2} = 1,5a + 1,5b = \dfrac{10,08}{22,4} = 0,45(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,2\\ \%m_{Fe} = \dfrac{0,1.56}{11}.100\% = 50,91\%\\ \%m_{Al} = 100\%-50,91\% = 49,09\%\)
Giỏi thế bạn ơi iiu bạn nhìu