Đốt cháy 51,2g Cu trong oxi a) tính thể tích oxi thu được. b) tính hiệu suất của phản ứng. Biết sau phản ứng thu được 48g CuO
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)=n_{Cu\left(p/ư\right)}\)
\(\Rightarrow n_{Cu\left(dư\right)}=\dfrac{12,8}{64}-0,15=0,05\left(mol\right)\)
\(\Rightarrow n_{O_2\left(cầnthêm\right)}=0,025mol\) \(\Rightarrow V_{O_2\left(thêm\right)}=0,025\cdot22,4=0,56\left(l\right)\)
\(n_{Cu} = \dfrac{12,8}{64} = 0,2(mol)\\ n_{CuO} = \dfrac{12}{80} = 0,15(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\)
Ta thấy : nCu = 0,2 > nCuO = 0,15 nên Cu dư.
Theo PTHH : \(n_{O_2\ } = \dfrac{1}{2}n_{CuO} = 0,075(mol)\)
Nếu đốt cháy hết lượng Cu ban đầu thì cần \(n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,1(mol)\)
Suy ra :
\(n_{O_2\ cần\ thêm} = 0,1 - 0,075 = 0,025(mol)\\ \Rightarrow V_{O_2} = 0,025.22,4 = 0,56(lít)\)

nS = 1,92/32 = 0,06 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,06 ---> 0,06 ---> 0,06
VSO2 (LT) = 0,06 . 22,4 = 1,344 (l)
VSO2 (TT) = 1,344 . 90% = 1,2096 (l)

\(n_{Cu}=\dfrac{51,2}{64}=0,8\left(mol\right)\\ PTHH:2Cu+O_2\underrightarrow{t^o}2CuO\\ \left(mol\right)....0,8\rightarrow..0,4.....0,8\\ m_{CuO}=0,8.80=64\left(g\right)\)

a) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,2--->0,2---->0,2
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c) \(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
0,2--->0,1
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
a: CuO+H2->Cu+H2O
0,2 0,2 0,2 0,2
mCu=0,2*64=12,8(g)
b: V=0,2*22,4=4,48(lít)

Gọi x, y lần lượt là số mol của Cu và Fe.
Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a. PTHH: 2Cu + O2 ---to---> 2CuO (1)
3Fe + 2O2 ---to---> Fe3O4 (2)
Ta có: \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PT(1): \(n_{Cu}=n_{CuO}=0,2\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{Cu}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}y\left(mol\right)\)
=> \(\dfrac{1}{2}x+\dfrac{2}{3}y=0,3\)
Mà nCu = 0,2(mol)
Thay vào, ta được: \(\dfrac{1}{2}.0,2+\dfrac{2}{3}y=0,3\)
=> y = 0,3(mol)
=> \(m_{Cu}=0,2.64=12,8\left(g\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
b. \(\%_{Cu}=\dfrac{12,8}{12,8+16,8}.100\%=43,24\%\)
\(\%_{Fe}=100\%-43,24\%=56,76\%\)

\(n_{KMnO_4}=\dfrac{63,2}{158}=0,4\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,4 0,2
=> \(V_{O_2\left(lt\right)}=0,2.22,4=4,48\left(l\right)\\
V_{O_2\left(tt\right)}=\dfrac{90.4,48}{100}=4,032\left(l\right)\)
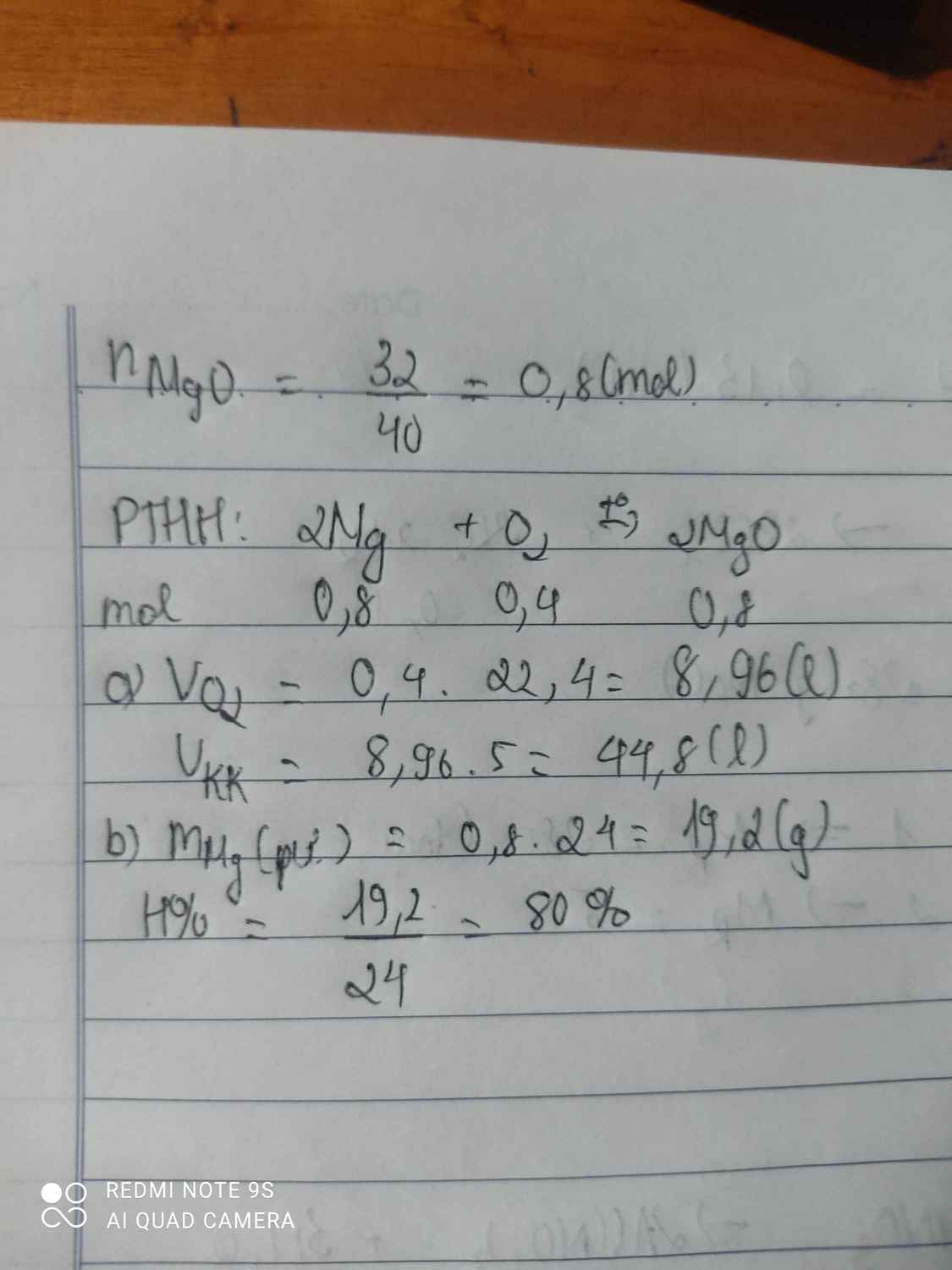
\(a) 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ n_{Cu} = \dfrac{51,2}{64} = 0,8(mol)\\ n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,4(mol) \Rightarrow V_{O_2} = 0,4.22,4 = 8,96(lít)\\ b) n_{Cu\ pư} = n_{CuO} = \dfrac{48}{80} = 0,6(mol)\\ \Rightarrow H = \dfrac{0,6}{0,8}.100\% = 75\%\)