Khi hòa tan 24,4 gam hỗn hợp Fe và \(Fe_2O_3\)bằng một lượng vừa đủ dung dịch HNO3 10% thấy thoát ta 3,36 lít khí không màu hóa nâu trong không khí (ở đktc,sản phẩm khử duy nhất)
a.Tính thành phần phần trăm về khối lượng trong hỗn hợp trên.
b.Tính khối lượng dung dịch axit HNO3 cần dùng
Cho NTK của H=1,N=14,O=16,Cu=64

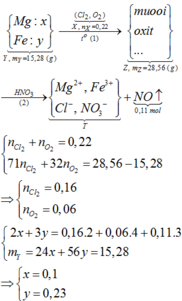
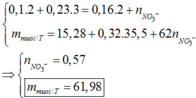


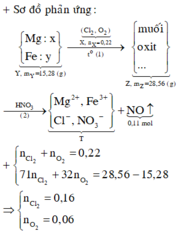


a)
$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$Fe_2O_3 + 6HNO_3 \to 2Fe(NO_3)_3 + 3H_2O$
Theo PTHH : $n_{Fe} = n_{NO} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Fe} = \dfrac{0,15.56}{24,4}.100\% = 34,4\%$
$\%m_{Fe_2O_3} = 100\% - 34,4\% = 65,6\%$
b)
$n_{Fe_2O_3} = 0,1(mol)$
$n_{HMO_3} = 4n_{Fe} + 6n_{Fe_2O_3} = 1(mol)$
$\Rightarrow m_{dd\ HNO_3} = \dfrac{1.63}{10\%} = 630(gam)$