Bài 3: Dẫn hidro đi qua 36g hỗn hợp gồm CuO và Fe2O3 nung nóng thu được hỗn hợp kim loại có khối lượng đồng gấp 4 lần khối lượng của sắt.
a) Tính khối lượng mỗi chất trong hh ban đầu. b) Thể tích hidro đã pư.
c) Khối lượng dd HCl 10,95% đủ để pư với lượng kim loại tạo ra ở trên.
Bài 4: Cho 1,95g kẽm tác dụng vừa đủ với 120g dd axit clohiđric, ta thu được dd A và khí B .
a) Viết phương trình phản ứng ? Tính thể tích khí B sinh ra ( đktc)
b) Tính nồng độ phần trăm của dung dịch axit clohidric và dd A thu được sau phản ứng ?

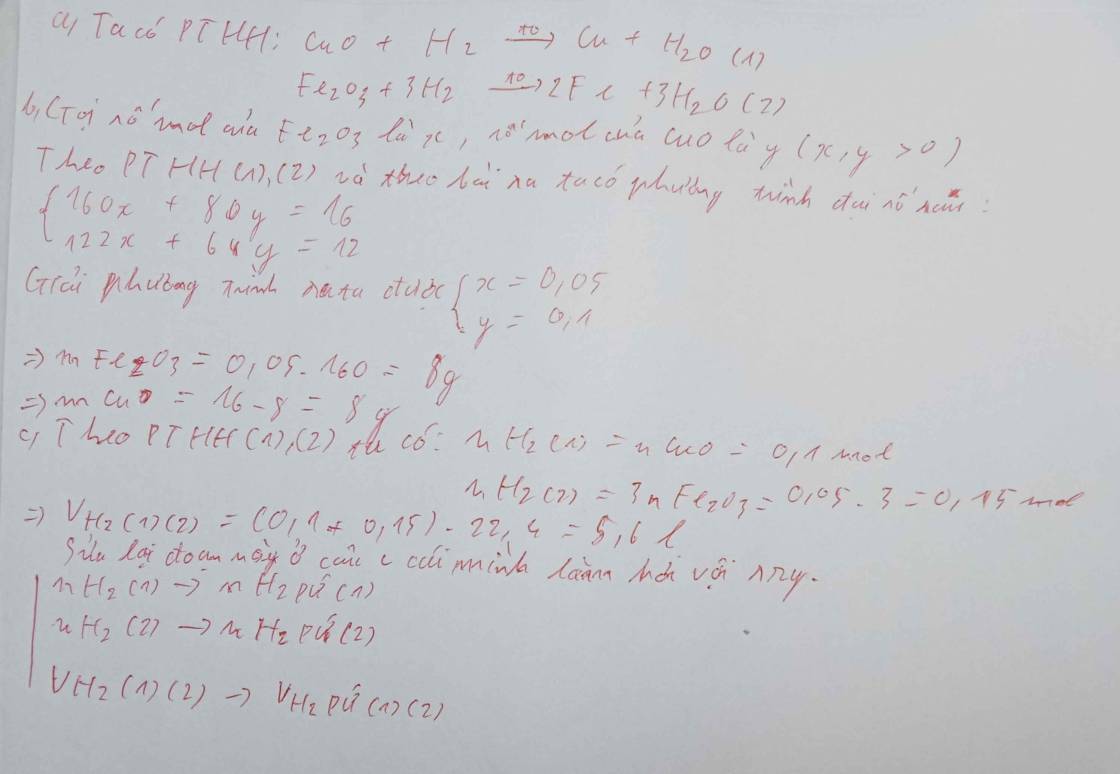

Bài 3 :
\(a) n_{CuO} = a(mol) ; n_{Fe_2O_3} = b(mol)\\ \Rightarrow 80a + 160b = 36(1)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + H_2O\\ n_{Cu} = n_{CuO} = a(mol)\\ n_{Fe} = 2n_{Fe_2O_3} = 2b(mol)\\ \Rightarrow 64a = 4.2b.56(2)\\ (1)(2) \Rightarrow a = 0,35 ; b = 0,05\\ m_{CuO} = 0,35.80 = 28(gam)\\ m_{Fe_2O_3} = 0,05.160 = 8(gam)\\ b) n_{H_2} = a + 3b = 0,5(mol) \Rightarrow V_{H_2} = 0,5.22,4 = 11,2(lít)\)
\(c) Fe + 2HCl \to FeCl_2 + H_2\\ n_{HCl} = 2n_{Fe} = 0,1.2 = 0,2(mol)\\ \Rightarrow m_{dd\ HCl} = \dfrac{0,2.36,5}{10,95\%} = 66,67(gam)\)
Bài 4 :
\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{1,95}{65} = 0,03(mol)\\ V_{H_2} = 0,03.22,4= 0,672(lít)\\ b) n_{HCl} =2 n_{H_2} = 0,06(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,06.36,5}{120}.100\% = 1,825\%\\ m_{dd\ sau\ pư} = 1,95 + 120 - 0,03.2 = 121,89(gam)\\ \Rightarrow C\%_{ZnCl_2} = \dfrac{0,03.136}{121,89}.100\% = 3,35\%\)