Câu 53: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự oxi hóa Cu. B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu. D. sự oxi hóa Fe và sự khử Cu2+.
Câu 54: Trong phản ứng: Cl2 + 2KOH → KCl + KClO + H2O
A. Cl2 là chất khử. C. Cl2 không là chất oxi hoá, không là chất khử.
B. Cl2 là chất oxi hoá. D. Cl2 vừa là chất oxi hoá, vừa là chất khử.
Câu 55: Số oxi hoá của crom trong CrO42- là
A. +2. B. +4. C. +6. D. +7.
Câu 56: Cho quá trình Fe2+ Fe 3++ 1e, đây là quá trình
A. oxi hóa. B. khử . C. nhận proton. D. tự oxi hóa – khử. Câu 57*: Tổng hệ số cân bằng của các chất tham gia trong phản ứng :
C + H2SO4 à CO2 + SO2 + H2O là
A. 5. B. 6 C. 3. D. 2.
Câu 58: Cho các phản ứng:
(1) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(2) 2H2S + SO2 → 3S + 2H2O
(3) 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
(4) 4KClO3 --to-→ KCl + 3KClO4
(5) O3 → O2 + O
Số phản ứng oxi hoá khử là
A. 5. B. 2. C. 3. D. 4.

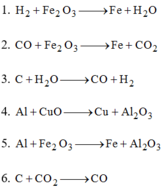
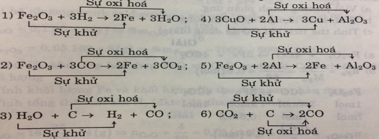
- Về bản chất, phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu để nhận ra loại phản ứng oxi hóa – khử là có sự thay đổi số oxi của các nguyên tử.
- Các bước lập phương trình hóa học của phản ứng oxi hóa – khử:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Nguyên tử Fe và C có sự thay đổi số oxi hóa, Fe là chất oxi hóa, C là chất khử
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
Fe+3 + 3e → Fe0
C+2 → C+4 + 2e
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc tổng electron nhường bằng tổng electron nhận.
2x /Fe+3 + 3e → Fe0
3x /C+2 → C+4 + 2e
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng.
Fe2O3+ 3CO \(\xrightarrow[]{t^oC}\) 2Fe + 3CO2