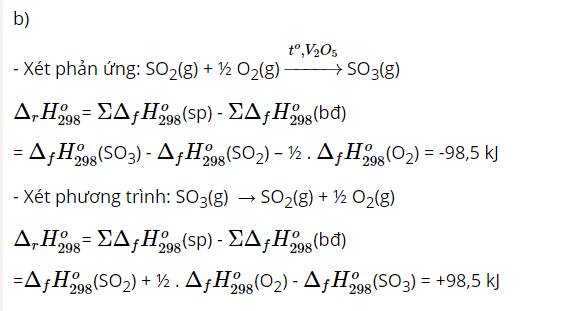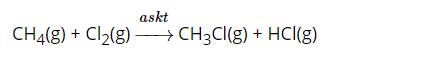Cho phương trình nhiệt hóa học sau:
SO2(g) + ½ O2(g) \(\underrightarrow{t^o,V_2O_5}\) SO3(g) Δr\(H^0_{298}\) = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3
b) Giá trị Δr\(H^0_{298}\)của phản ứng: SO3(g) → SO2(g) + ½ O2(g) là bao nhiêu?