Khỏi nung nóng hỗn hợp A gồm KMnO4 và KClO3 đến khi phản ứng hết thì khối lượng giảm 1/4 so với ban đầu. Xác định phần trăm theo khối lượng KClO3 trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol KMnO4, KClO3 là a, b
=> 158a + 122,5b = 49,975
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
_______a----------------------------------->a
2KClO3 --to--> 2KCl + 3O2
_b---------------------->1,5b
mO2 = mgiảm = 10,4
=> \(n_{O_2}=\dfrac{10,4}{32}=0,325\left(mol\right)\)
=> 0,5a + 1,5b = 0,325
=> a = 0,2; b = 0,15
=> \(\left\{{}\begin{matrix}\%KMnO_4=\dfrac{0,2.158}{49,975}.100\%=63,23\%\\\%KClO_3=\dfrac{0,15.122,5}{49,975}.100\%=36,77\%\end{matrix}\right.\)

Gọi số mol KMnO4, KClO3 là a, b
=> 158a + 122,5b = 49,975
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
2KClO3 --to--> 2KCl + 3O2
mO2 = mgiảm = 10,4
=> \(n_{O_2}=\dfrac{10,4}{32}=0,325\left(mol\right)\)
=> 0,5a + 1,5b = 0,325
=> a = 0,2; b = 0,15
=> \(\left\{{}\begin{matrix}\%KMnO_4=\dfrac{0,2.158}{49,975}.100\%=63,23\%\\\%KClO_3=\dfrac{0,15.122,5}{49,975}.100\%=36,77\%\end{matrix}\right.\)

Gọi $n_{KMnO_4} = a(mol) ; n_{KClO_3} = b(mol) \Rightarrow 158a + 122,5b = 49,975(1)$
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$m_{O_2} = m_{giảm} = 4(gam)$
$\Rightarrow n_{O_2} = 0,5a + 1,5b = \dfrac{4}{32} = 0,125(2)$
Từ (1)(2) suy ra a = 0,339 ; b = -0,029 < 0
(Sai đề)

Do khối lượng chất rắn trong X và Y bằng nhau
=> Lượng O2 sinh ra khi phân hủy KClO3 phản ứng hết với Cu
PTHH: 2KClO3 --to--> 2KCl + 3O2
a--------------->1,5a
2Cu + O2 --to--> 2CuO
3a<--1,5a
=> b \(\ge\) 3a

giả sử có 100g KMnO4, KClO3
⇒m chất rắn =75g
2KMnO4\(\underrightarrow{^{to}}\)K2MnO4+MnO2+O2
x___________x/2_____ x /2__ x/2 (mol)
2KClO3→2KCl+3O2
y _________y___3y/2
\(\left\{{}\begin{matrix}\text{158x+122.5y=100}\\\text{142x+74.5y=75 }\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}\text{x=0.3}\\\text{y=0.4 }\end{matrix}\right.\)
⇒mKMnO4⇒%
⇒mKClO3⇒%

Gọi n KMnO4 = a
n KClO3 = b ( mol )
--> 158a + 122,5 b = 43,3
PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
0,9b 1,35b
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,9a 0,45a
\(\%Mn=\dfrac{55a}{43,3-32\left(0,45a+1,35b\right)}=24,103\%\)
\(\rightarrow a=0,15\)
\(b=0,16\)
\(m_{KMnO_4}=0,15.158=23,7\left(g\right)\)
\(m_{KClO_3}=0,16.122,5=19,6\left(g\right)\)

mgiảm = mO2 (sinh ra) = 200 + 3 - 145,4 = 57,6 (g)
\(\rightarrow n_{O_2}=\dfrac{57,6}{32}=1,8\left(mol\right)\)
PTHH: 2KClO3 --to, MnO2--> 2KCl + 3O2
1,2 1,8
\(\rightarrow m_{KClO_3}=1,2.122,5=147\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{147}{200}=73,5\%\\\%m_{KCl}=100\%-73,5\%=26,5\%\end{matrix}\right.\)
Khối lượng oxi thoát ra: 197 + 3 – 152 = 48(g)
Số mol O2=4832=1,5(mol)O2=4832=1,5(mol)
Phương trình hóa học của phản ứng :
2KClO3MnO2,to⟶2KCl+3O22KClO3⟶MnO2,to2KCl+3O2
2 mol 3 mol
1,5×23=1mol1,5×23=1mol ←← 1,5 mol
Khối lượng KClO3KClO3 trong hỗn hợp : 1 x 122,5 =122,5 (g)Khối lượng KCl trong hỗn hợp ban đầu: 197 – 122,5 = 74,5(g)→%mKClO3=62,18%;%mKCl=37,82%→%mKClO3=62,18%;%mKCl=37,82%
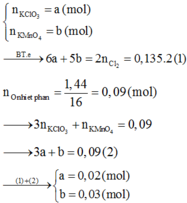
\(KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ 2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ m_{giảm}=\dfrac{1}{4}m_A\\ Đặt:x=n_{KMnO_4};y=n_{KClO_3}\left(x,y>0\right)\\ m_{O_2}=m_{giảm}=\dfrac{1}{4}m_A=\dfrac{1}{4}.\left(158x+122,5y\right)\\ Mặt.khác:m_{O_2}=32x+\dfrac{245}{3}y\\ \Rightarrow\dfrac{158x+122,5y}{4}=\dfrac{96x+245y}{3}\\ \Leftrightarrow90x=612,5y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{612,5}{90}=\dfrac{245}{36}\\ \Rightarrow\%m_{\dfrac{KClO_3}{hhA}}=\dfrac{36.122,5}{36.122,5+245.158}.100\approx10,227\%\)