Câu 7: Cho 2,3 gam Na vào nước du a) Viết PTHH xảy ra? b) Tính khối lượng chất tan trong dung dịch sau phản ứng? c) Cho tất cả khi thu được ở trên đi qua ống thủy tinh chứa 10 gam CuO nung nóng. Tính khối lượng chất rắn thu được sau khi phản ứng kết thúc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Giả sử hỗn hợp chỉ có Zn => nhh = nZn = 10/65 ~ 0,154 mol
=> nHCl = 2nZn = 0,308(mol) > nHCl(theo đề) =0,14 mol
=> HCl phản ứng hết còn hỗn hợp kim loại dư
Ta có : nB = nCu = nCuO = nH2 = 1/2 nHCl = 0,07 (mol) => mB = mCu = 0,07.64 = 4,48 < 12,48
=> Trong B còn có CuO dư => x = 12,48 - 4,48 + 0,07.80 = 13,6(g)
b)Theo đề có :
nNaOH = 0,1(mol) ;nCuO = 0,1 mol
=> nHCl = 0,1 + 0,1.2 = 0,3 mol ; nCuCl2 = 0,1 mol
Mà \(C\%_{CuCl2}=\dfrac{0,1.135}{mdd}.100=27\%\) => mdd = 50(g) => mdd HCl = 50-8=42(g)
=> y = C%HCl = (10,95/42).100~26,071%

a)\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,3 0,3 0,3
\(V_{H_2}=0,3\cdot22,4=6,67l\)
\(m_{FeCl_3}=0,3\cdot127=38,1g\)
b)\(n_{Fe_2O_3}=\dfrac{18}{160}=0,1125mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,1125 0,3 0 0
0,1 0,3 0,2 0,3
0,0125 0 0,2 0,3
\(m_{Fe}=0,2\cdot56=11,2g\)

nCuO=12/80=0,15(mol)
nH2=2,24/22,4=0,1(mol)
a) PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,15/1 > 0,1/1
-> CuO dư, H2 hết => Tính theo nH2
b) Ta sẽ có: nCu= nCuO(p.ứ)=nH2O= nH2=0,1(mol)
=> mH2O=0,1.18=1,8(g)
c) nCuO(dư)=0,15 - 0,1= 0,05(mol)
m(rắn)= mCu + mCuO(dư)= 0,1.64 + 0,05.80= 10,4(g)
=>a=10,4(g)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15\left(mol\right)\)
a) Pt : H2 + CuO → Cu + H2O\(|\)
1 1 1 1
0,1 0,15 0,1 0,1
b) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\)
⇒ H2 phản ứng hết , CuO dư
⇒ Tính toán dựa vào số mol của H2
b) Số mol của nước
nH2O = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của nước
mH2O = nH2O . MH2O
= 0,1. 18
= 1,8 (g)
Số mol của đồng
nCu = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,1 . 64
= 6,4 (g)
Chúc bạn học tốt

Định hướng tư duy giải
Ta có:
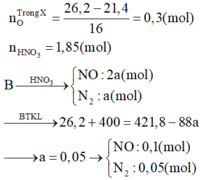

Chất tan trong bình gồm hỗn hợp muối và HNO3 dư.
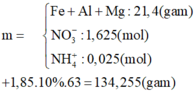

\(n_{Ba}=\dfrac{24,66}{137}=0,18\left(mol\right)\\
pthh:Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
0,18 0,18
\(\Rightarrow V_{H_2}=0,18.22,4=4,032\left(L\right)\\
n_{CuO}=\dfrac{15,2}{80}=0,19\left(mol\right)\\
pthh:H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
\(LTL:0,18< 0,19\)
=> CuO dư
theo pthh : \(n_{CuO\left(p\text{ư}\right)}=n_{Cu}=n_{H_2}=0,18\left(mol\right)\)
=> \(m_{Kl}=\left(64.0,18\right)+\left(80.0,1\right)=19,52\left(g\right)\)

a) 2Al+6HCl→2AlCl3+3H22Al+6HCl→2AlCl3+3H2
b) nAl=5,427=0,2(mol)nAl=5,427=0,2(mol)
Theo phương trình : nH2=32nAl=0,3(mol)nH2=32nAl=0,3(mol)
→VH2(đktc)=0,3.22,4=6,72(l)→VH2(đktc)=0,3.22,4=6,72(l)
c) Chất rắn : 0,2(mol)0,2(mol)
CuO dư : 0,2(mol)Cu0,2(mol)Cu
%CuO=0,2.80(0,2.80+0,2.64).100=55,56%%CuO=0,2.80(0,2.80+0,2.64).100=55,56%
%Cu=44,44%%Cu=44,44%
a)\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
b)\(V_{H_2}=0,3\cdot22,4=6,72l\)
c)\(n_{CuO}=\dfrac{32}{80}=0,4mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,4 0,3 0,3
\(m_{Cu}=0,3\cdot64=19,2g\)

nAl = 5.4/27 = 0.2 (mol)
2Al + 6HCl => 2AlCl3 + 3H2
0.2.......0.6......................0.3
CM HCl = 0.6 / 0.4 = 1.5 (M)
nCuO = 32/80 = 0.4 (mol)
CuO + H2 -to-> Cu + H2O
0.2.......0.2..........0.2
Chất rắn : 0.2 (mol) CuO dư , 0.2 (mol) Cu
%CuO =\(\dfrac{0,2.80}{0,2.80+0,2.64}\) 100% = 55.56%
%Cu = 44.44%
a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo phương trình : \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(\rightarrow V_{H_2}\left(đktc\right)=0,3.22,4=6,72\left(l\right)\)
c) Chất rắn : \(0,2\left(mol\right)\)
CuO dư : \(0,2\left(mol\right)Cu\)
\(\%CuO=\dfrac{0,2.80}{\left(0,2.80+0,2.64\right)}.100=55,56\%\)
\(\%Cu=44,44\%\)
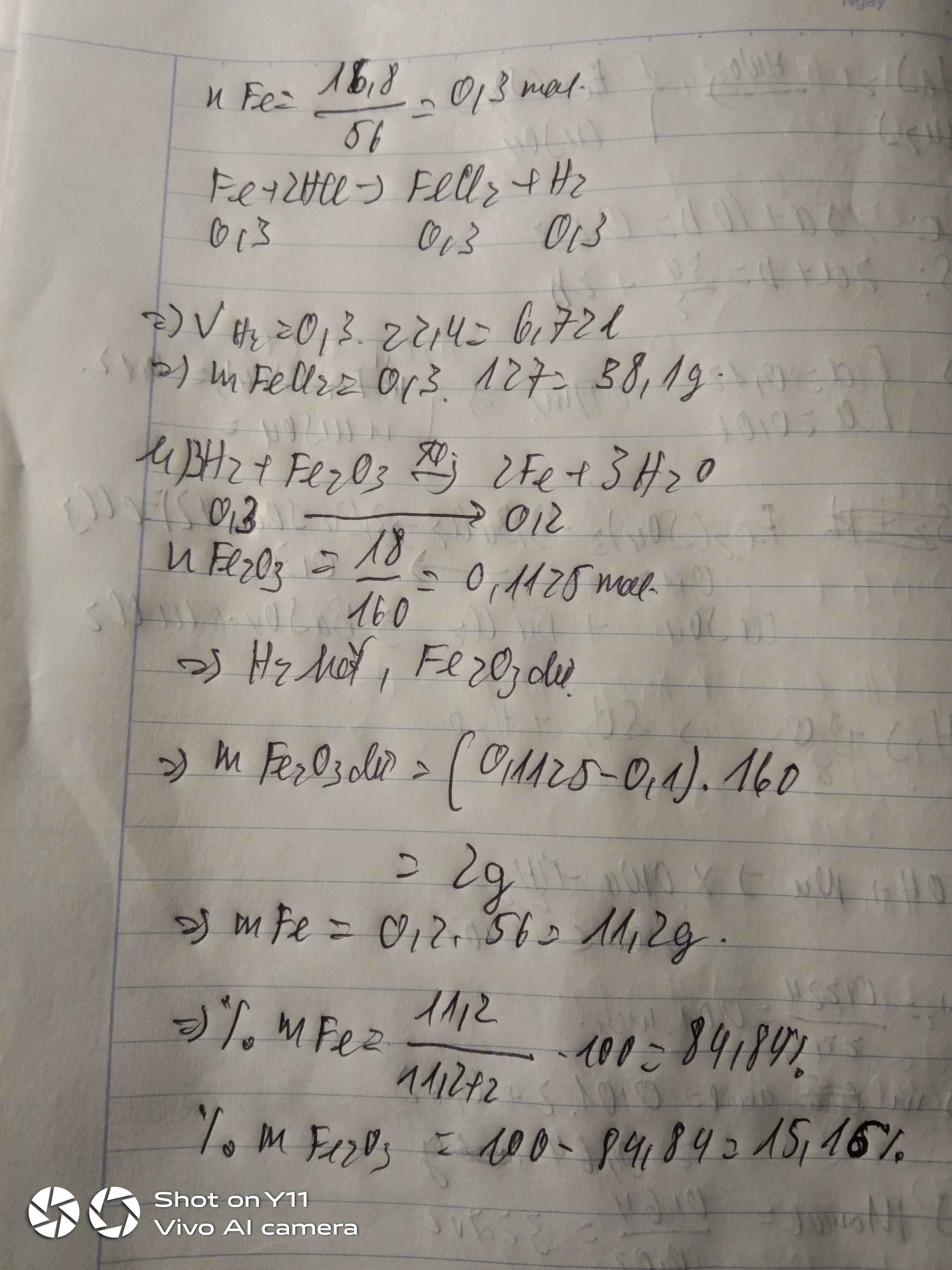
a) PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
b) Ta có: \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)=n_{NaOH}\) \(\Rightarrow m_{NaOH}=0,1\cdot40=4\left(g\right)\)
c) PTHH: \(H_2+CuO\xrightarrow[]{t^o}Cu+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=0,05\left(mol\right)\\n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) CuO còn dư, Hidro p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=0,05\left(mol\right)\\n_{CuO\left(dư\right)}=0,075\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_{rắn}=m_{Cu}+m_{CuO}=9,2\left(g\right)\)