đốt cháy 5,6 lít khí etan(C2H6) bằng oxi trong không khí.tính thể tích không khí cần dùng và khối lượng khí CO2 tạo thành.Biết oxi chiếm 20% thể tích không khí,các thể tích khí đo ở điều kiện tiêu chuẩn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Các khí đo ở cùng điều kiện nhiệt độ , áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol
C8H18 + 25/2O2 --> 8CO2 + 9H2O
Theo pt : 1 25/2 8 9 (lít)
Theo đề bài 8 <------100
Theo đề bài 240 ------> 3000
Vậy thể tích khí C8H18 cháy trong 500l không khí tức 100 lít Oxi là 8 lít,
Thể tích oxi cần dùng để đốt cháy hết 240 lít C8H18 là 3000 lít

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
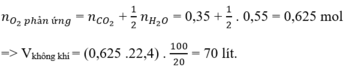

Ta có: \(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
a, \(n_{O_2}=3n_{C_2H_4}=1,5\left(mol\right)\Rightarrow V_{O_2}=1,5.22,4=33,6\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=168\left(l\right)\)
b, \(n_{CO_2}=2n_{C_2H_4}=1\left(mol\right)\Rightarrow m_{CO_2}=1.44=44\left(g\right)\)

nCH4 = 4,48/22,4 = 0,2 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,4
Vkk = 0,2 . 5 . 22,4 = 44,8 (l)
mCO2 = 0,2 . 44 = 8,8 (g)
mH2O = 0,4 . 18 = 7,2 (g)
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
Mol: 0,2 <--- 0,2 ---> 0,2
mCaCO3 = 0,2 . 100 = 20 (g)

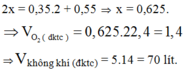

\(n_{C_2H_6}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: \(2C_2H_6+7O_2\xrightarrow[]{t^o}4CO_2+6H_2O\)
0,25--->0,875
`=> V_{O_2} = (0,875.22,4)/(20%) = 98 (l)`