Cho 9,2 gam hỗn hợp Zn và Al tác dụng với dung dịch \(H_2SO_4\) thoát ra 5,6 lít khí \(H_2\) (đktc)
1. Viết các phương trình phản ứng
2. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu
3. Tính khối lượng \(ZnSO_4\) và \(Al_2\left(SO_4\right)_3\) tạo thành sau phản ứng

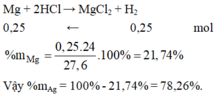
1. \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2. Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\) ⇒ 65x + 27y = 9,2 (1)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y=\dfrac{5,6}{22,4}=0,25\left(mol\right)\left(2\right)\)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{9,2}.100\%\approx70,65\%\\\%m_{Al}\approx29,35\%\end{matrix}\right.\)
3. Theo PT: \(\left\{{}\begin{matrix}n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnSO_4}=0,1.160=16\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\end{matrix}\right.\)