Hoà tan hoàn toàn 9,4 gam oxit của kim loại R (hoá trị I không đổi) trong dung dịch có chứa 3,65 gam HCl. Cô cạn dung dịch sau phản ứng thu được 13,05 gam chất rắn khan. Tìm kim loại R?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
.0,12/n...............0,12/n......0,06......
\(R_2O_n+2nHCl\rightarrow2RCl_n+nH_2O\)
.0,3/n......................................0,3....
\(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
Có : \(m=13,44=m_R+m_{R_2O_n}=\dfrac{0,12R}{n}+\dfrac{\left(2R+16n\right)0,3}{n}\)
\(\Rightarrow R=12n\)
=> R là Mg
\(n_{Al\left(I\right)}=\dfrac{3}{2}n_{H_2}=0,045\left(mol\right)\)
\(n_{Al\left(II\right)}=2n_{Al_2O_3}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.2n_{O_2}=\dfrac{4}{3}n_{O_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=m=3,015\left(g\right)\)

Đáp án B
M + 2HCl → MCl2 + H2
M (M+71)
8,45g 17,68g
=> 17,68.M = 8,45.(M+71)
=> M = 65 (Zn)

Đáp án B
M + 2HCl -> MCl2 + H2
M g (M + 71)g
8,45g 17,68g
=> 17,68.M = 8,45.(M + 71)
=> M = 65g (Zn)

Gọi oxit của kim loại đó là A2On
\(n_{A_2O_n}=\dfrac{10}{2.M_A+16n}=\dfrac{5}{M_A+8n}\left(mol\right)\)
PTHH: A2On + 2nHCl --> 2ACln + nH2O
=> \(n_{ACl_n}=\dfrac{10}{M_A+8n}\left(mol\right)\)
=> \(M_{ACl_n}=M_A+35,5n=\dfrac{23,75}{\dfrac{10}{M_A+8n}}\left(g/mol\right)\)
=> MA = 12n (g/mol)
- Nếu n = 1 => MA = 12 (loại)
- Nếu n = 2 => MA = 24(Mg)
- Nếu n = 3 => MA = 36 (Loại)
Vậy kim loại đó là Mg

PTHH
R2O +2HCl-----> 2RCl + H2O
Theo định luật bảo toàn khối lượng ta có
mNước =mR2O+mHCl -mRCl2
= 14,1 + 7,3 -20,5=0,9(g)
n\(_{H2O}=\frac{0,9}{18}=0,05\left(mol\right)\)
Theo pthh
n\(_{R2O}=n_{H2O}=0,05\left(mol\right)\)
M\(_{R2O}=\frac{14,1}{0,05}=282\left(g\right)\)
Theo bài ra ta có
2R+16=282
=> 2R=266
=>R=133
Hình như đề sai hay sao ý bạn
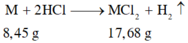
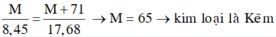

CTHH oxit : $R_2O$
$n_{HCl} = \dfrac{3,65}{36,5} = 0,1(mol)$
\(R_2O+2HCl\rightarrow2RCl+H_2O\)
0,05 0,1 0,1 (mol)
\(R_2O+H_2O\rightarrow2ROH\)
x 2x (mol)
Ta có :
$m_{R_2O} = (0,05 + x)(2R + 16) = 9,4(gam)$
$\Rightarrow 0,1R + 2Rx + 16x = 8,6$(1)
$m_{chất\ rắn} = m_{RCl} + m_{ROH} = 0,1(R + 35,5) + 2x(R + 17)=13,05$
$\Rightarrow 0,1R + 2Rx + 34x = 9,5$(2)
Lấy (2)- (1) : $18x = 0,9 \Rightarrow x = 0,05$
$n_{R_2O} = 0,05 + x = 0,1(mol)$
$\Rightarrow M_{R_2O} = 2R + 16 = \dfrac{9,4}{0,1} = 94$
$\Rightarrow R = 39(Kali)$