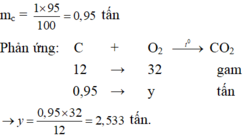Tính khối lượng khí oxi cần dùng để đốt cháy hoàn toàn 1 tấn than (chứa 95% cacbon). Những tạp chất còn lại không cháy được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng C có trong 1,5 tấn than là: \(m_C=\dfrac{1,5.95}{100}=1,425\) (g)
\(n_C=\dfrac{m}{M}=\dfrac{1,425}{12}=\dfrac{19}{160}\)(mol)
PTHH: C + O2 → CO2
Theo PT: \(n_{O_2}=n_C=\dfrac{19}{160}\)
Khối lượng khí oxi cần dùng là: \(m_{O_2}=n.M=\dfrac{19}{160}.32=3,8\)(g)

Khối lượng C chứa trong 1 tấn than:
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
12---32-------gam
0,96--x-------tấn
\(\Rightarrow x=\dfrac{0,96.32}{12}=2,56\left(\text{tấn}\right)\)

\(m_C=84\%.1000=840\left(g\right)\Rightarrow n_C=\dfrac{840}{12}=70\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{O_2}=n_C=70\left(mol\right)\Rightarrow m_{O_2}=70.32=2240\left(g\right)\)

a) Ta có PTHH
C + O2 \(\rightarrow\) CO2
mC(phản ứng) = 1 . 95% = 0.95 (tấn)
theo PT: 32g O2 : 12g C
theo ĐB : x tấn O2 : 0.95 tấn C
=> x = 0.95 x 32 : 12 =2.533 (tấn)
vậy mO2 = 2.533 tấn
b) ta có PTHH
CH4 + 2O2 \(\rightarrow\) 2H2O + CO2
Theo PT : 16g CH4 : 64g O2
Theo ĐB : 4kg CH4 : x kg O2
=> x = 4 x 64 : 16 =16 kg O2
c) Ta cóPTHH
2H2 + O2 \(\rightarrow\) 2H2O (1)
CH4 + 2O2 \(\rightarrow\) CO2 + 2H2O (2)
CÓ:
nH2 = m/M = 8/2 = 4 (mol)
nCH4 = m/M = 2/16 =0.125(mol)
theo PT(1)=> nO2 = 1/2 . nH2 = 1/2 . 4 =2 (mol)
theo PT(2) => nO2 =2 . nCH4 = 2 x 0.125 =0.25(mol)
=> tổng nO2 = 2 + 0.25 = 2.25(mol)
=> mO2 = n . M = 2.25 x 32 =72(g)

Ta có: \(m_C=1,5.1000.90\%=1350\left(g\right)\)
\(n_C=\dfrac{1350}{12}=112,5\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_{O_2}=n_C=112,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=112,5.22,4=2520\left(l\right)\)
\(V_{kk}=V_{O_2}.5=12600\left(l\right)\)