nêu tính chất hóa học của silic đioxit và cho ví dụ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




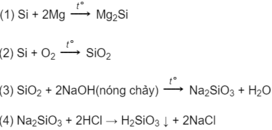
Dãy chuyển hóa có thể là:
![]()
Các phương trình hóa học có thể là:

Câu 1 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa đỏ
+ Tác dụng với kim loại :
vd : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
+ Tác dụng với oxit bazo :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2\)
+ Tác dụng với bazo :
vd : \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(KOH+HCl\rightarrow KCl+H_2O\)
Chúc bạn học tốt
Câu 2 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa xanh
+ Tác dụng với oxit axit :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
+ Tác dụng với axit :
vd : \(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
+ Bazo không tan bị nhiệt phân hủy :
vd : \(Zn\left(OH\right)_2\rightarrow\left(t_o\right)ZnO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow\left(t_o\right)Fe_2O_3+3H_2O\)
Chúc bạn học tốt

Oxi: Tính chất hóa học : oxi là một đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
2SO2 + O2 → 2SO3
2Fe + O2 + 2H2O → 2Fe(OH)2
C5H12O2 + 7O2 → 5CO2 + 6H2O
Hidro: Tính chất hóa học
- Hidro là phi kim, Hydro có hóa trị 1 và có thể phản ứng với hầu hết các nguyên tố hóa học khác.
Bị kim loại (Fe, Ni, Pt, Pd) hấp thụ hóa học. Chất khử mạnh ở nhiệt độ cao. Hiđro nguyên tử Ho có khả năng khử đặc biệt cao, được tạo nên khi nhiệt phân hiđro phân tử H2 hay do phản ứng trực tiếp trong vùng tiến hành quá trình khử.
a. Tác dụng với kim loại
- Hidro tác dụng được với nhiều kim loại mạnh tạo hợp chất hidrua.
Ví dụ: H2 + 2Na → 2NaH (natri hidrua)
b. Tác dụng với phi kim: Hidro tác dụng được với nhiều phi kim
H2 + Cl2 → 2HCl
2H2 + O2 → 2H2O
3H2 + N2 → 2NH3.
c. Tác dụng với oxit kim loại
- Hidro khử được nhiều oxit kim loại ở nhiệt độ cao.
Ví dụ: FeO + H2 → Fe + H2O
CuO + H2 → Cu + H2O
Nước:
Tính chất hóa học của nước
- Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
- Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
- Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4

tc hóa học của oxi là
+t/c vs phi kim; vd 5O2 +4P --\(t^0\) ---> 2P2O5
+ t/c vs kim loại; Vd 2Mg +O2--\(t^0\) --> 2MgO
+ tác dụng với hợp chất; vd: 2O2+ CH4--\(t^0\) ---> CO2 + 2H2O
tính chất hóa học của H
+ tác dụng vs oxi; vd 2H2 + O2--\(t^0\) ---> 2H2O
+ tác dụng vs 1 số oxit bazo; vd: H2 + HgO--\(t^0\) ---> H2O +Hg
t/c hóa học của nc
+ t/d vs kim loại: 2K + 2H2O ---> 2KOH +H2
+ t/d vs 1 số oxit bazo: Na2O + H2O---> 2NaOH
+ t/d vs 1 số oxit axit : SO2 + H2O---- > H2SO3

nêu tính chất hóa học của oxi
-Oxi là một chất không màu, không mùi, ít tan trong nước.
- Oxi có khối lượng phân tử là 32 nên oxi nặng hơn không khí. - Oxi khi bị hóa lỏng ở nhiệt độ -1830C sẽ có màu xanh nhạt và có thể bị hút bởi nam châm.

- Tác dụng với kim loại tạo oxit bazo tương ứng :
\(2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
- Tác dụng với phi kim :
\(S + O_2 \xrightarrow{t^o} SO_2\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
- Tác dụng với một số hợp chất khác :
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ H_2S + \dfrac{3}{2}O_2 \xrightarrow{t^o} SO_2 + H_2O\)
1. Tác dụng với hầu hết với các kim loại ở nhiệt độ cao trừ Au,Pt,Ag
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2. Tác dụng với một số phi kim ở nhiệt độ cao
\(C+O_2\underrightarrow{t^o}CO_2\)
3. Tác dụng với một số hợp chất khác:
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Tham khảo:
Tính chất của SiO2:
SiO2 là oxit axit. Ở nhiệt độ cao, tác dụng với kiềm và oxit bazơ tạo thành muối silicat. Silic đioxit không phản ứng với nước.
Ví dụ:
SiO2 + 2NaOHSiO2 + CaO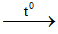 CaSiO3 (canxi silicat)
CaSiO3 (canxi silicat)