Dung dịch A chứa x mol H+, 0,12 mol Cu2+ ; 0,15 mol NO3- và 0,15 mol SO42-. Cho tác dụng với 400ml dung dịch Ba(OH)2 0,05M thu được m gam kết tủa. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Bảo toàn điện tích ta có nSO42– = 0 , 1 × 2 + 1 , 2 - 0 , 3 2 = 0,55 mol.
⇒ Bảo toàn khối lượng có mMuối = 0,1×64 + 0,3×35,5 + 1,2×23 + 0,55×96 = 97,45 gam.

Đáp án B
Bảo toàn điện tích: nCl- = 3nAl3+ + 2nCu2+ - 2nSO42- = 0,1
mmuối =mAl3+ + mCu2+ + mSO42- + mCl- = 31,85g

Chọn D
Bảo toàn điện tích có: 0,07 + 3a = 0,12 + 0,02.2 → a = 0,03 mol
Cho X vào hỗn hợp KOH và Ba(OH)2:
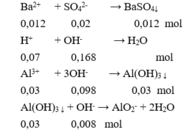
Sau phản ứng thu được kết tủa là:
BaSO 4 0,012 (mol) và Al ( OH ) 3 : 0,03 – 0,008 = 0,022 (mol).
m↓ = 0,012.233 + 0,022.78 = 4,512 gam.

Đáp án C
Fe + 2Ag+ → Fe2+ + 2Ag+
Fe + Cu2+ →Fe2+ + Cu
→ dung dịch có 2 muối nên c/2 ≤ a < c/2 + b

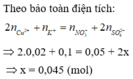


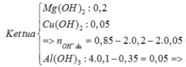
\(n_{Ba^{2+}}=0,4.0,05=0,02mol\\ n_{OH^-}=0,04mol\\ m=98.0,02+233.0,02=6,62g\)