Cho biết năng lượng liên kết giảm dần theo thứ tự từ fluorine đến iodine:
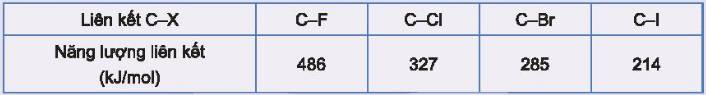
Từ giá trị năng lượng C – X ở trên, hãy so sánh khả năng phân cắt liên kết C – X của các dẫn xuất halogen.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Liên kết đơn C – C có gồm 1 liên kết σ có năng lượng là 368 kJ mol-1.
Liên kết đôi C = C gồm 1 liên kết σ và liên kết π có năng lượng là 636 kJ mol-1.
=> Năng lượng của liên kết π là: 636 – 368 = 268 (kJ mol-1)
Vì năng lượng của liên kết σ (368 kJ mol-1) lớn hơn năng của liên kết π (268 kJ mol-1) nên khi phân tử tham gia phản ứng, liên kết π dễ bị bẻ gãy hơn.

a)
- Phân tử H2S:
+ Năng lượng liên kết của S – H là: 368 kJ mol-1.
+ Vì có 2 liên kết S – H
⟹ Tổng năng lượng liên kết trong phân tử H2S là: 368.2 = 736 (kJ mol-1)
- Phân tử H2O:
+ Năng lượng liên kết của O – H là: 464 kJ mol-1.
+ Vì có 2 liên kết O – H
⟹ Tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol-1)
b)
- Ta thấy năng lượng liên kết của H2S là 38 kJ mol-1 ; của H2O là 928 kJ mol-1.
⟹ Năng lượng liên kết của H2S < H2O.
⟹ Liên kết của H2O bền hơn H2S.
⟹ Nhiệt độ phân hủy của H2O > H2S.

+ Độ bền vững của hạt nhân được xét dựa trên năng lượng liên kết riêng: ![]()
+ ![]() có Wlkr = 1,11 MeV;
có Wlkr = 1,11 MeV; ![]() có Wlkr = 2,83 MeV;
có Wlkr = 2,83 MeV; ![]() có Wlkr = 7,04 MeV.
có Wlkr = 7,04 MeV.
→ Độ bền vững hạt nhân sắp xếp theo thứ tự giảm dần là: ![]()
Đáp án C

a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
a) Phương trình F2(g) + H2(g) → 2HF(g)
Δ𝑟𝐻0298 = -535 kJ
Phương trình: O2(g) + 2H2(g) → 2H2O (g)
Δ𝑟𝐻0298 = -842 kJ
b ) Phản ứng của oxygen thuận lợi hơn
Khả năng phân cắt liên kết C−X của các dẫn xuất halogen: C-F < C-Cl < C-Br < C-I.