Nhiệt phân hoàn toàn một lượng Cu(OH)2 thu được 4gam một chất rắn màu đen a.tính khối lượng của Cu(OH)2 đem nhiệt phân b.hoà tận hết lượng Cu(OH)2 trên bằng 250g dung dịch H2SO4 9.8% thu được dung dịch X.Tính nồng độ phần trăm của các chất có trong dung dịch X sau khi phản ứng kết thúc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)

a)
Cu(OH)2 ➝ CuO + H2O (2)
CuO + H2SO4➝ CuSO4 + H2O (1)
Đổi : 100ml= 0,1lít
Số mol axit sunfuric cần dùng là:
n= CM . V = 0,1 . 2=0,2 mol
Từ (1) ➜ nH2SO4= nCuO= 0,2mol
Khối lượng CuO đã nhiệt phân là:
m= n.M= 0,2. 80=16 (g)
Từ (2)➜nCu(OH)2= nCuO=0,2 mol
Khối lượng đồng hiđroxit đã dùng là:
m= n.M = 0,2.98=19,6 (g)
b)
Từ (1)➙ nCuSO4=nCuO= 0.2mol
Khối lượng muối thu được là:
m=n.M= 0,2 . 160=32 (g)
O

Chọn A
Để hỗn hợp tan hết thì số mol oxi sinh ra khi nhiệt phân phải ít nhất vừa đủ để oxit hóa kim loại tự do Þ nCu max = nCu(NO3)2 = 44/(252) =11/63 => mCu < 64x11/63 = 11,17 gam.
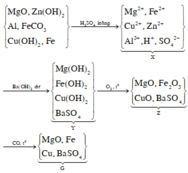
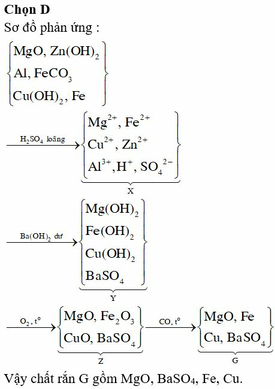

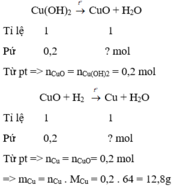
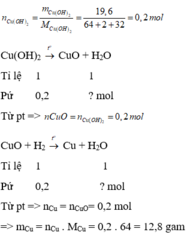
a, \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
b, \(m_{H_2SO_4}=250.9,8\%=24,5\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,25}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{H_2SO_4\left(pư\right)}=n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,25-0,05=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05.160}{4,9+250}.100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2.98}{4,9+250}.100\%\approx7,69\%\end{matrix}\right.\)