: Để xác định phần trăm khối lượng vỉa hỗn hợp A gồm nhôm và magie, người ta thực hiện hai thí nghiệm sau: - Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng với dung dịch H₂SO₄ loãng dư, thu được 1568 ml khí ở điều kiện tiêu chuẩn - Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư thì sau phản ưng thấy còn lại 0,6 gam chất rắn. Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%

Ở thí nghiệm 2: Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
Chất rắn còn lại là Mg = 0,6 gam hay = 0,6 : 24 = 0,025 mol
Ở thí nghiệm 1: Số moi H2 = 1,568 : 22,4 = 0,07 mol. Gọi x là số mol Al.
Phương trình hóa học:
2Al + 3H2S04 \(\rightarrow\) Al2(S04)3 + 3H2
x \(\rightarrow\) 1,5x (mol)
Mg + H2S04 \(\rightarrow\) MgS04 + H2
0,025 \(\rightarrow\) 0,025 (mol)
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = mol Al Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
%Mg = \(\dfrac{0,6}{1,41}\) x 100% = 42,55%; %Al = 100% - 42,55% = 57,45%.
Ở thí nghiệm 2: Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
Chất rắn còn lại là Mg = 0,6 gam hay = 0,6 : 24 = 0,025 mol
Ở thí nghiệm 1: Số moi H2 = 1,568 : 22,4 = 0,07 mol. Gọi x là số mol Al.
Phương trình hóa học:
2Al + 3H2S04 → Al2(S04)3 + 3H2
x → 1,5x (mol)
Mg + H2S04 → MgS04 + H2
0,025 → 0,025 (mol)
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = mol Al Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
%Mg = x 100% = 42,55%; %Al = 100% - 42,55% = 57,45%.

Ta có: \(\left\{{}\begin{matrix}n_{Mg}=\dfrac{0,6}{24}=0,025\left(mol\right)\\n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(2n_{Mg}+3n_{Al}=2n_{H_2}\) \(\Rightarrow n_{Al}=\dfrac{2n_{H_2}-2n_{Mg}}{3}=0,45\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,6}{0,6+0,45\cdot27}\cdot100\%\approx4,71\%\\\%m_{Al}=95,29\%\end{matrix}\right.\)

* TN2:
Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
=> Chất rắn còn lại là Mg = 0,6 (g)
=> nMg = 0,6/24 = 0,025 mol
* TN1:
nH2 = 1,568/22,4 = 0,07mol
Gọi x là số mol Al.
PTHH: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
_______x _________________________1,5x
PTHH: Mg + H2SO4 -> MgSO4 + H2
______0,025 _________________0,025
Ta có: 1,5x + 0,025 = 0,07 => x = nAl = 0,03mol
=> m = mMg + mAl = 0,6 + 0,03.27 = 1,41g
=> %Mg = (0,6/1,41).100% = 42,55%
=> %Al = 100% - 42,55% = 57,45%.

Chọn đáp án B
Thí nghiệm 1: R ( C H 2 O H ) n + n C u O → t o R ( C H O ) n + n C u + n H 2 O
Áp dụng tăng giảm khối lượng có:
nCuO phản ứng = 4 , 8 16 = 0 , 3 m o l ⇒ n a n c o l = 0 , 3 n m o l
n A g = 90 , 72 108 = 0 , 84 m o l ⇒ n A g n a n c o l = 0 , 84 0 , 3 n = 2 , 8 n
→ Chứng tỏ 2 ancol là CH3OH (x mol) và C2H5OH (y mol)
⇒ x + y = 0 , 3 4 x + 2 y = 0 , 84 ⇒ x = 0 , 12 y = 0 , 18
Thí nghiệm 2: 6,51 gam ete tương ứng với 0,105 mol ete.
Đặt số mol X, Y phản ứng tạo ete lần lượt là a, b.
→ nancol phản ứng = a + b = 2nete = 0,21 mol, n H 2 O = n e s t e = 0 , 105 m o l
→ mancol phản ứng = 32a + 46b = 6,51 + 18.0,105 = 8,4 g
→ a = 0 , 09 b = 0 , 12
→ Phần trăm số mol Y phản ứng = 0 , 12 0 , 18 . 100 % = 66 , 67 %

Đáp án D
Đốt cháy a mol hỗn hợp T thu được a mol H2O do vậy hai axit trong T chứa 2H.
Do đó T gồm HCOOH và HOOC-COOH.
Cho a mol T tác dụng với NaHCO3 thu được 1,6a mol CO2.
![]()
%HCOOH=25,41%

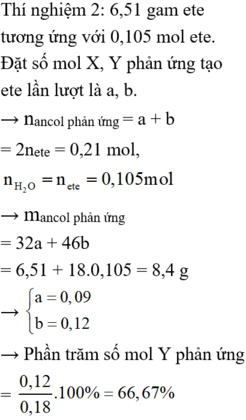

- TN2: m chất rắn = mMg = 0,6 (g)
- TN1: \(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Ta có: \(n_{Mg}=\dfrac{0,6}{24}=0,025\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Mg}\Rightarrow n_{Al}=0,03\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,6}{0,6+0,03.27}.100\%\approx42,55\%\\\%m_{Al}\approx57,45\%\end{matrix}\right.\)