Hoà tan hoàn toàn m (gam) hỗn hợp Al và Cu vào dd HNO3 loãng đủ thu được 3,9664 lít khí không màu hoá nâu trong không khí thoát ra và dd X. Nếu cũng cho m (gam) hh trên tác dụng với dd H2SO4 loãng thu được 2,9748 lít khí thoát ra (các khí đều đo ở đkc). Tính m gam hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)

a)
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
n H2 = 16,8/22,4 = 0,75(mol)
Theo PTHH :
n Al = 2/3 n H2 = 0,5(mol)
n NO2 = 44,8/22,4 = 2(mol)
Theo PTHH :
n Cu = 1/2 n NO2 = 1(mol)
Suy ra :
m = 0,5.27 + 1.64 = 77,5(gam)
TH2 : Nếu axit HNO3 đã dùng là axit đặc nóng
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
$Al + 6HNO_3 \to Al(NO_3)_3 + 3NO_2 + 3H_2O$
n H2 = 16,8/22,4 = 0,75(mol)
n NO2 = 44,8/22,4 = 2(mol)
Theo PTHH :
n Al = 2/3 n H2 = 0,75.2/3 = 0,5(mol)
n NO2 = 2n Cu + 3n Al = 2n Cu + 0,5.3 = 2(mol)
=> n Cu = 0,25(mol)
Suy ra :
m = 0,5.27 + 0,25.64 = 29,5 gam

Đặt nMg = a
nAl = b
Ta có, hệ pt: 24a + 27b = 9
2a + 3b = 0.3x3
=> a = 0.15, b= 0.2
%mMg = 40%
%mAl = 60%
Khi cho KOH dư thì Al(OH)3 sẽ tan tạo KAlO2 => m tủa = m Mg(OH)2 = 0.15x58 = 8,7 (g)

Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)

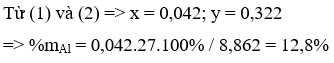


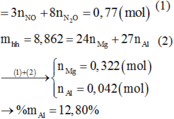
Td với H2SO4:
\(n_{H_2}=\dfrac{2,9748}{24,79}=0,12mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al}=\dfrac{0,12.2}{3}=0,08mol\)
Td với HNO3:
\(n_{Al}=a=0,08mol\\ n_{Cu}=b\)
Khí hoá nâu trong không khí → NO
\(n_{NO}=\dfrac{3,664}{24,79}=0,16mol\\ 3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\\ Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(\Rightarrow a+\dfrac{2}{3}b=0,16\\ \Leftrightarrow0,08+\dfrac{2}{3}b=0,16\\ \Leftrightarrow b=0,12mol\\ \Rightarrow m=0,08.27+0,12.64=9,84g\)