Cho 21,2 g muối cacbonate của kim loại R có hóa trị 1 tác dụng hết với dung dịch HCl thấy thoát ra 4,958 lít khí CO2 ở điều kiện chuẩn xác định công thức muối cacbonat và tính phần trăm theo khối lượng của mỗi nguyên tố có trong mỗi cacbonate
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi M là kí hiệu nguyên tử khối của kim loại hoá trị I. Công thức muối là M 2 CO 3 . Phương trình hoá học của phản ứng :
M 2 CO 3 + 2HCl → 2 MCl 2 + H 2 O + CO 2
(2M + 60)g 22400ml
1,06g 224ml
Theo phương trình hóa học trên ta có:
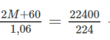
→ M = 23. Đó là muối Na 2 CO 3

Đáp án C
Ta có: nCO2= 0,112/22,4= 0,005 mol
- TH1: Muối cacbonat trung hòa:
Đặt công thức của muối là R2CO3
R2 CO3+ 2HCl → 2RCl+ CO2+ H2O
Theo PTHH: nR2CO3= nCO2= 0,005 mol
→ MR2CO3= 0,53/ 0,005=106
→ MR= 23 → Na → Na2CO3
- TH2: Muối cacbonat axit
Đặt công thức của muối là RHCO3
RHCO3+ HCl → RCl+ CO2+ H2O
Theo PTHH: nRHCO3= nCO2= 0,005 mol
→ MRHCO3= 0,53/ 0,005=106
→ MR= 465 → Loại

\(Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ b,m_{MgCl_2}=95.0,1=9,5\left(g\right)\\ c,m_{ddMgCl_2}=m_{Mg}+m_{ddHCl}-m_{H_2}=2,4+200-0,1.2=202,2\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{9,5}{202,2}.100\approx4,698\%\\ d,n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\\ PTHH:H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\\ Vì:\dfrac{0,2}{1}>\dfrac{0,1}{1}\Rightarrow CuOdư\\ n_{CuO\left(dư\right)}=0,2-0,1.1=0,1\left(mol\right)\\ m_{CuO\left(dư\right)}=0,1.80=8\left(g\right)\)

Bài 2: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\)
Theo PTHH: \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=127\cdot0,1=12,7\left(g\right)\)

a)
$M + 2HCl \to MCl_2 + H_2$
$n_{HCl} = 0,3.1 = 0,3(mol)$
Theo PTHH : $n_M = \dfrac{1}{2}n_{HCl} = 0,15(mol)$
$\Rightarrow M = \dfrac{3,6}{0,15} = 24(Mg)$
b)
$n_{MgCl_2} = n_{Mg} = 0,15(mol)$
$m_{MgCl_2} = 0,15.95 = 14,25(gam)$
c) $n_{H_2} = n_{Mg} = 0,15(mol)$
$V_{H_2} = 0,15.22,4 = 3,36(lít)$

Đáp án D
Đặt công thức của hai muối là RCO3: x mol
RCO3+ 2HCl → RCl2+ CO2+ H2O
x 2x x x mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat+ mHCl= m muối clorua+ mCO2+ mH2O
→ 7,0 + 2x. 36,5=9,2+ 44x+18x → x= 0,2 mol→ VCO2= 0,2.22,4= 4,48 lít


\(n_{CO_2}=\dfrac{V}{24,79}=0,2\left(mol\right)\)
PTHH: \(R_2CO_3+2HCl\rightarrow2RCl+CO_2+H_2O\)
Mol: 0,2 0,2
\(\Rightarrow n_{R_2CO_3}=0,2\left(mol\right)\)
Mặt khác: \(n_{R_2CO_3}=\dfrac{m}{M}\Rightarrow\dfrac{m}{M}=0,2\)
\(\Rightarrow M=\dfrac{m}{0,2}\Leftrightarrow2R+12+3\cdot16=\dfrac{21,2}{0,2}\)
\(\Rightarrow R=23=Na\)
\(\Rightarrow\left\{{}\begin{matrix}\%Na=\dfrac{2M_{Na}}{M}\cdot100\%=\dfrac{2\cdot23}{23\cdot2+12+16\cdot3}\cdot100\%\approx43,4\%\\\%O=\dfrac{3M_O}{M}\cdot100\%=\dfrac{3\cdot16}{23\cdot2+12+16\cdot3}\cdot100\%\approx45,3\%\\\%C=100\%-\%Na-\%O\approx11,3\%\end{matrix}\right.\)