Hòa tan hoàn toàn hỗn hợp gồm Fe,FeO,Fe2O3 và Fe3O4 vào 63g dung dịch HNO3 thì thu được 0,336 lít khí NO (đktc, duy nhất). Cho dung dịch sau phản ứng tác dụng vừa đủ với 450ml dung dịch NaOH 1M thu được kết tủa lớn nhất. Lọc kết tủa nung đến khối lượng không đổi thu được 8,0 gam chất rắn. Nồng độ phần trăm của dung dịch HNO3 là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

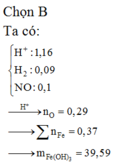
Đáp án : A
nFe(OH)3 = 0,1 mol = nFe bđ => mO(X) = 4g
Qui X về 0,1 mol Fe và 0,25 mol O
Bảo toàn e : 3nFe = 2nO + 3nNO
=> nNO < 0 (Vô lý)
=> Fe3+ còn dư so với OH-
=> nOH- = nHNO3 dư + 3nFe(OH)3 => nHNO3 dư = 0,05 mol
=> nHNO3 pứ = 0,6 – 0,05 = 0,55 mol
Bảo toàn e : 3nFe = 2nO + 3nNO ; nHNO3 = 3nFe + nNO
Lại có : 56nFe + 16nO = 9,6g
=> nFe = 0,15 ; nO = 0,075 mol => nNO = 0,1 mol
=> V= 2,24 lit

Mình làm câu này rồi nè, bạn tham khảo bài làm của mình ở link này nha
https://hoc24.vn/cau-hoi/hoa-tan-hoan-toan-576-gam-hon-hop-a-gom-fe3o4-fe2o3-feo-fe-trong-dung-dich-hcl-thi-can-dung-360-gam-dung-dich-hcl-1825-de-tac-dung-vua-du-sau-phan-ung-thu-duoc-v-lit-h2-dktc-va-dung-dich-b-c.1336663119282
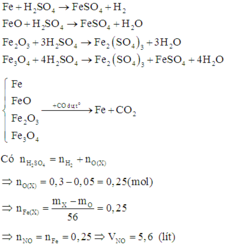
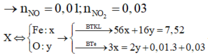
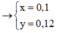
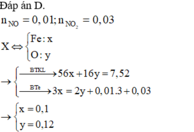
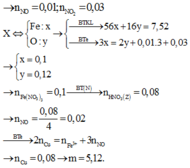
Theo gt ta có: $n_{NO}=0,015(mol);n_{NaOH}=0,45(mol);n_{Fe_2O_3}=0,05(mol)$
Quy hỗn hợp về Fe và O
Bảo toàn e ta có: $n_{O}=0,1275(mol)$
Ta có: $n_{n_{Fe(OH)_3}=0,3(mol)\Rightarrow n_{H^+/du}=0,15(mol)$
Dùng phương trình $H^+$ ta được $n_{HNO_3}=0,465(mol)$
$\Rightarrow \%m_{HNO_3}=46,5\%$
n Fe2O3 = 8/160 = 0,05(mol)
=> n Fe(OH)3 = 2n Fe2O3 = 0,1(mol)
Ta có :
n NaOH = n HNO3(dư) + 3n Fe(OH)3
=> n HNO3 dư = 0,45 - 0,1.3 = 0,15(mol)
n NO = 0,015(mol)
Bảo toàn electron :
3n Fe = 2n O + 3n NO
<=> n O = (0,1.3 - 0,015.3)/2 = 0,1275(mol)
Phân bổ H+ :
n HNO3 = n HNO3 pư + n HNO3 dư = 2n O + 4n NO + n HNO3 dư
= 0,1275.2 + 0,015.4 + 0,15 = 0,465(mol)
C% HNO3 = 0,465.63/63 .100% = 46,5%