Hòa tan hoàn toàn 6,4 gam hỗn hợp X gồm Na, K, Na2O, Ba và BaO vào nước, thu được 200 ml
dung dịch Y và V lít khí H2. Trộn 100 ml dung dịch Y với 100 ml dung dịch gồm HCl 0,4M và HNO3 0,6M
thu được 200 ml dung dịch Z có pH = 13. Cô cạn dung dịch Z, thu được 8,04 gam chất rắn khan. Giá trị của
V là
A. 0,672. B. 0,448. C. 0,560. D. 0,896
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
nH+ = nHCl + 2nH2SO4 = 0,1 mol
Dung dịch sau có pH = 13 => COH- = 0,1M => nOH- = 0,04 mol
=> nOH (Y) = 0,14 mol = ånKL.(số điện tích)
Lại có : 2nH2 = nOH ( do các kim loại tạo ra) = 0,14 mol với 400 ml Y
=> Với 200 ml dung dịch Y có nOH tạo ra do kim loại = 0,07 mol
=> nOH tạo ra do oxit = 0,07 mol = ånKL(oxit).(số điện tích) = 2nO (bảo toàn điện tích)
=> nO = 0,035 mol
Để tạo 400 ml Y thì nO = 0,035.2 = 0,07 mol
=> m = 12,8g

Chọn B.
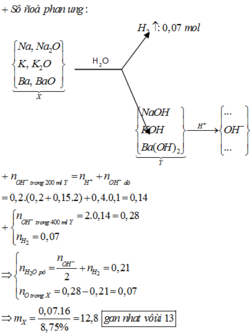
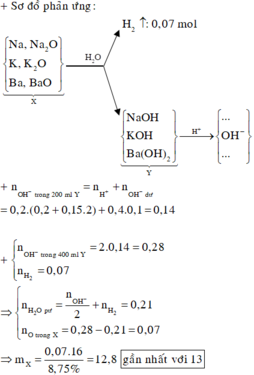
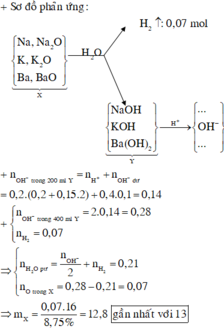
Dung dịch sau có pH = 13 nên sau phản ứng còn dư kiềm: nOH-dư = 0,1.0,4 = 0,04 mol.
⇒ n O H - Y = 0,04+0,2.(0,2+0,2.0,15)=0,14 mol
Quy đổi X tương đương với hỗn hợp gồm: Na (x mol), K (y mol), Ba (z mol), O (t mol).
⇒ l6t = 8,75% m.
Theo định luật bảo toàn electron, ta có: x + y + z = 2t + 2 n H 2
⇒ t = (2.0,14 - 2.0,07) : 2 = 0,07 mol ⇒ m = 12,8 ≈ 13 gam.
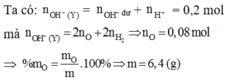


Coi X gồm :
Na(a mol) ; Ba(b mol) ; O(c mol) - Về bản chất Na giống Kali nên quy về nguyên Na
=> 23a + 137b + 16c = 6,4(1)
n H+ = 0,1.0,4 + 0,1.0,6 = 0,1(mol)
n OH- dư = 0,2.10^-14/10^-13 = 0,02(mol)
=> n OH(trong 100 ml Y) = 0,1 + 0,02 = 0,12(mol)
=> n OH(trong 200 ml Y) = 0,12.2 = 0,24(mol)
=> a + 2b = 0,24(2)
Cô cạn Z, thu được :
Na : 0,5a(mol)
Ba : 0,5b(mol)
Cl- : 0,04(mol)
NO3- : 0,06(mol)
OH- : 0,02(mol)
=> 0,5a.23 + 0.5b.137 + 0,04.35,5 + 0,06.62 + 0,02.17 = 8,04(3)
Từ (1)(2)(3) suy ra c = 0,08(mol) - Số liệu a,b nếu lẻ ngoặc âm đều được chấp nhận.
Bảo e :
a + 2b = 2n O + 2n H2
<=> 0,24 = 0,08.2 + 2n H2
<=> n H2 = 0,04(mol)
<=> V = 0,04.22,4 = 0,896 lít