Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Áp dụng phương pháp khối lượng mol trung bình, ta có
M = ![]() = 32
= 32
24 = M1 < 32 < M2 = 40

Đáp án B
Hướng dẫn Áp dụng phương pháp khối lượng mol trung bình, ta có
![]()
→ 24= M1 < 32 <M2 = 40

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(2X+H_2SO_4\rightarrow X_2SO_4+H_2\)
0,2 \(\leftarrow\) 0,1
\(\Rightarrow\overline{M_X}=\dfrac{5,4}{0,2}=27\) \(\Rightarrow X_1< 27< X_2\)
Mà X1, X2 thuộc nhóm IA
\(\Rightarrow\left\{{}\begin{matrix}X_1:Na\\X_2:K\end{matrix}\right.\) Gọi \(n_{Na}=x\left(mol\right)\) , \(n_K=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}BTKL:23x+39y=5,4\\BTe:x+y=2n_{H_2}=0,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}x=0,15mol\\y=0,05mol\end{matrix}\right.\)
\(\%m_{Na}=\dfrac{0,15\cdot23}{5,4}\cdot100\%=63,89\%\)
\(\%m_K=100\%-63,89\%=36,11\%\)
Khi cô cạn dung dịch thu được muối: \(\left\{{}\begin{matrix}n_{Na^+}=0,15mol\\n_{K^+}=0,05mol\\n_{SO_4^{2-}}=n_{H_2SO_4}=n_{H_2}=0,1mol\end{matrix}\right.\)
\(\Rightarrow m_{m'}=0,15\cdot23+0,05\cdot39+0,1\cdot\left(32+4\cdot16\right)=15g\)

Đáp án B
Số mol H2 thu được là: n H 2 = 4 , 48 22 , 4 = 0 , 2 m o l
Gọi M là kim loại chung cho hai kim loại nhóm IIA
Hai kim loại nhóm IIA đều hóa trị II => M cũng hóa trị II
Sơ đồ phản ứng: M 0 + H C + 1 l → + M C l 2 + 2 + H 2 0
Các quá trình nhường, nhận electron:
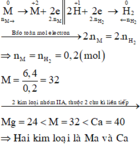

Bài 1
Gọi mol X là x, mol Y là Y
n\(_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
2X+2xH2O--->2X(OH)x+xH2
n\(_{OH}=2n_{H2}=0,5\left(mol\right)\)=> \(x+2y=0,5\rightarrow\frac{x}{2}+y=0,25\)
=> M\(_{tb}=\frac{7,1}{x+y}\rightarrow\frac{7,1}{x+2y}< M_{tb}< \frac{7,1}{\frac{x}{2}+y}\)
=> 14,2<Mtb<28
=> X có thể là Na,Y có thể là Mg
Bài 3
oxit cao nhất của chu kỳ 2 là N2O5
Oxxit cao nhất của chu kỳ 3 là R2O5
Bài 4
CTHH: RO3
Theo bài ta có
\(\frac{48}{R+48}.100\%=60\)
=>\(\frac{48}{R+48}=0,6\rightarrow48=0,6R+28,8\)
=> \(0,6R=19,2\rightarrow R=32\)lưu huỳnh
=>CTHH:SO3
Bài 5
CTHH: Y2O3
Theo bài ta có
\(\frac{2Y}{2Y+48}=38,8\rightarrow\frac{2Y}{2Y+112}=0388\)
= \(2Y=0,776Y+18,624\)
=>\(1,224Y=18,624\)
=>Y=14(Ni tơ)
CTHH:N2O3
Bài 6
CTHH:RO
Theo bài
\(\frac{R}{R+16}.100\%=10,46\rightarrow\frac{R}{R+16}=0,1046\)
=> R=0,1046R+1,67
=>0,8954R=1,67
Xem lại đề
Câu 1:
Giả sử chỉ KL kiềm tác dụng vs HCl
\(n_{KL}=\text{2. nH2=0,5}\Rightarrow PTK_{tb}=\text{m hh/ 0,5=14,2}\)
Giả sử chỉ cs KL kiềm thổ ác dụng
n Kiềm thổ =n H2 =0,25 ---> PTK trung bình< mhh/0,25=28,4
2KL đó là Na và Mg
Câu 2
\(\text{GỌi Ct chung của 2 KL đó là A}\)
PTK trung bình của A = 18/0,5=36----> 2 Kl đó là Mg và Ca


bn đăng tách câu hỏi ra nhé
1)
Nguyên tử của nguyên tố A có phân lớp ngoài cùng là np4 -> lớp ngoài là ns2 np4
\(\text{-> nhóm VIA }\)
-> Hơp chất với H có dạng RH2
\(\text{->%H=2/(R+2)=11,1% -> R=16 -> O (oxi)}\)
2)
Cation R3+ có cấu hình phân lớp ngoài cùng là np6
-> Lớp ngoài là ns2 np6
Cấu hình ngoài của R :\(\text{ n+1 ns2 np1}\)
-> Hợp chất oxit cao nhất của R là \(\text{R2O3 -> 16.3/(2R +16.3)=25,53% -> R=70 }\)
3)
\(\text{Gọi 2 kim loại là R , R nhóm IIA nên có hóa trị II.}\)
\(\text{R + 2H2O -> R(OH)2 + H2}\)
Ta có nH2=0,1 mol
-> nR=0,1
\(\text{-> M R=3,2/0,1=32}\)
Ta có 24 < 32 < 40 -> hai kim loại là Mg và Ca.
4)
Ta có :
\(\text{R + H2O -> ROH + 1/2 H2}\)
\(\text{K + H2O -> KOH +1/2 H2}\)
\(\text{ROH + HCl -> RCl + H2O}\)
\(\text{KOH + HCL -> KCl + H2O }\)
-> nROH + nKOH=nHCl=0,25 mol
-> nR + nK=0,25 mol
-> M trung bình hỗn hợp=7,35/0,25=29,4
Vì M K =39 > 29,4 -> kim loại còn lại là Li hoặc Na
Nếu là Li x mol K y mol -> \(\text{7x+39y=7,35}\)
\(\text{x+y=0,25 }\)-> nghiệm dương -> thỏa mãn
Nếu là Na x mol và K y mol -> \(\text{23x+39y=7,35}\)
\(\text{x+y =0,25}\) -> nghiệm dương thỏa mãn
-> Li hoặc Na