
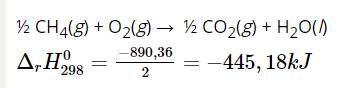
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

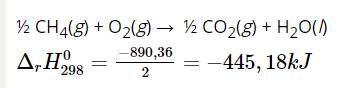
Giá trị ${\Delta _r}H_{298}^0$ của phản ứng sau là bao nhiêu kJ?
½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l)

½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l) ${\Delta _r}H_{298}^0 = \frac{{ - 890,36}}{2} = - 445,18kJ$

Giả sử: 1 gam C và Al
+ 1 gam C có 1/12 mol
1 mol C : ${\Delta _r},H_{298}^0$ = -393,5 kJ
1/12 mol C ${\Delta _r},H_{298}^0$ = -32,79 kJ
+ 1 gam Al có 1/27 mol
2 mol Al : ${\Delta _r},H_{298}^0$= -1675,7 kJ
1/27mol Al : ${\Delta _r},H_{298}^0$= -31,03 kJ
⇒ Với cùng một khối lượng C và Al, C khi đốt cháy tỏa ra nhiều nhiệt hơn.

\(\Delta_fH^{^{ }o}_{298}\left[CH_4\right]=-\left(-890,3-\left(-393,5\right)-\left(-285,8\right)\right)\\ \Delta_fH^{^{ }o}_{298}\left[CH_4\right]=211kJ\cdot mol^{-1}\)

\(C_2H_6+\dfrac{7}{2}O_2->2CO_2+3H_2O\\ \Delta_rH^o_{298}=2\left(-393,5\right)+3\left(-285,8\right)-\left(-84,7\right)\\ \Delta_rH^o_{298}=-1559,7kJ\)
Phương trình nhiệt hoá học thì không cần ghi điều kiện nhé.

\(\Delta_rH^{^o}_{298}=945+494-2\cdot607=+225kJ\\ \Rightarrow D\)
Bạn ơi, bạn có biết gì về Eb không vậy? Mình tính Eb(cđ) - Eb(sp) mà? Công thức đó đâu ra vậy?