Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Biểu diễn sự hình thành liên kết ion giữa
a. Natri và Oxy
b. Canxi và Nitơ
c. Nhôm và Flo
d. Kali và Clo

a)
Na0 --> Na+ + 1e
O0 + 2e--> O2-
Do ion Na+ và O2- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện
2Na+ + O2- --> Na2O
b)
Ca0 -->Ca2+ + 2e
N0 +3e--> N3-
Do ion Ca2+ và N3- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện
3Ca2+ + 2N3- --> Ca3N2
c)
Al0 --> Al3+ + 3e
F0 +1e--> F-
Do ion Al3+ và F- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện
Al3+ + 3F- --> AlF3
d)
K0 --> K+ + 1e
Cl0 +1e--> Cl-
Do ion K+ và Cl- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện
K+ + Cl- --> KCl

a)
Na0 --> Na+ + 1e
Cl0 + 1e --> Cl-
Do ion Na+ và Cl- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Na+ + Cl- --> NaCl
b)
K0 --> K+ + 1e
O0 + 2e --> O-2
Do ion K+ và O-2 trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
2K+ + O-2 --> K2O
c)
Ca0 --> Ca+2 + 2e
Cl0 +1e--> Cl-
Do ion Ca+2 và Cl- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Ca+2 + 2Cl- --> CaCl2
d)
Mg0 --> Mg+2 + 2e
O0 + 2e --> O-2
Do ion Mg+2 và O-2 trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Mg+2 + O-2 --> MgO

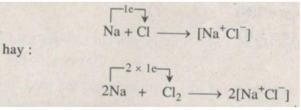
Ta đã biết natri là một kim loại có khuynh hướng nhường electron để trở thành một ion dương có cấu hình electron vững bền và clo là một phi kim có khuynh hướng nhận electron để trở thành một ion âm có cấu hình electron vững bền. Vì vậy khi cho clo tiếp xúc với natri thì trước hết có hiện tượng chuyển electron từ nguyên tử Na sang nguyên tử Cl. Từ đó xuất hiện các ion tích điện khác dấu (âm và dương) và sau đó do lực hút tĩnh điện giữa các ion nên liên kết ion được hình thành.
Phản ứng hoá học giữa natri và clo có thể được diễn tả bằng phương trình hoá học :

Cấu hình e của F-: 1s22s22p6
Cấu hình e của Ca2+: 1s22s22p63s23p6
Ca0 -2e --> Ca2+
F0 +1e--> F-
2 ion Ca2+ và F- trái dấu nên chúng hút nhau bằng lực hút tĩnh điện, tạo nên phân tử CaF2: Ca2+ + 2F- --> CaF2

Ta đã biết kim loại và phi kim có độ âm điện rất khác nhau, chúng dễ tương tác với nhau tạo thành các hợp chất ion, thí dụ NaCl, CaF 2 , KBr,... Trong khi đó, giữa các phi kim, hiệu độ âm điện không lớn nên chúng dễ tương tác với nhau tạo thành các hợp chất có liên kết cộng hoá trị, thí dụ: Cl 2 , NO, ...


Chọn C
Cấu hình electron nguyên tử Cl là [Ne]3s23p5 → Loại B và D
Cấu hình electron nguyên tử Ca là [Ar]4s2 → loại A
Liên kết hình thành giữa Ca (kim loại mạnh) và Cl (phi kim mạnh) trong hợp chất CaCl2 là liên kết ion.