Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,PTHH:Fe_3O_4+4H_2\xrightarrow{t^o}3Fe+4H_2O\\ n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol);n_{Fe_3O_4}=\dfrac{46,4}{232}=0,2(mol)\)
Vì \(\dfrac{n_{H_2}}{4}<\dfrac{n_{Fe_3O_4}}{1}\) nên \(Fe_3O_4\) dư
\(n_{Fe_3O_4(dư)}=0,2-\dfrac{0,3}{4}=0,125(mol)\\ \Rightarrow m_{Fe_3O_4(dư)}=0,125.232=29(g)\\ b,n_{Fe}=\dfrac{3}{4}n_{H_2}=0,225(mol)\\ \Rightarrow m_{Fe}=0,225.56=12,6(g)\)

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 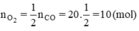
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
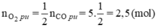 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

$3Fe_2+2O_2\xrightarrow{t^o}Fe_3O_4$
Theo PT: $n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=\dfrac{1}{3}.0,15=0,05(mol)$

\(2KClO_3-^{t^o}>2KCl+3O_2\) phản ứng phân hủy
\(3Fe+2O_2-^{t^o}>Fe_3O_4\) phản ứng hóa hợp
\(2Al+6HCl->2AlCl_3+3H_2\) phản ứng thế

`1)`
`a) 3Fe + 2O_2 -> Fe_3O_4`
`b) 3NaOH + FeCl_3 -> Fe(OH)_3 + 3NaCl`
`c) N_2 + 3H_2 -> 2NH_3`
`d) 2KClO_3 -> 2KCl + 3O_2` (Đáng ra là `KClO_3` chứ?)
`e) 4C_xH_y + (4x+y)O_2 -> 4xCO_2 + 2yH_2O`
`2)`
`a) 2Mg + O_2 -> 2MgO`
`b) 2Fe + 3Cl_2 -> 2FeCl_3`
`c) 2NaOH + CuCl_2 -> Cu(OH)_2 + 2NaCl`
`d) H_2 + Cl_2 -> 2HCl`
`e) Mg + 2HCl -> MgCl_2 + H_2`
`3)`
`a) n_{Fe} = m/M = (5,6)/(56) = 0,1 (mol)`
`b) V_{H_2(đktc)} = n.22,4 = 0,25.22,4 = 5,6 (l)`
`c) n_{CO_2} = (V_{(đktc)})/(22,4) = (4,48)/(22,4) = 0,2 (mol)`
`=> m_{CO_2} = n.M = 0,2.44 = 8,8 (g)`
`d)` \(n_{CO_2}=\dfrac{9,6.10^{23}}{6.10^{23}}=1,6\left(mol\right)\)
`4)`
`a) CO_2: \%C = (12)/(44) .100\% = 27,27\%`
`\%H = 100\% - 27,27\% = 72,73\%`
`b) CaO: \%Ca = (40)/(56) .100\% = 71,43\%`
`\%O = 100\% - 71,43\% = 28,57\%`

Phương trình phản ứng đốt cháy H2 trong ôxi:
Vậy ngưng tụ sản phẩm: chất lỏng A là H2O có khối lượng: 0,2.18 = 3,6 (g);Khí B là oxi
khi cho B phản ứng với Fe: (2)[/FONT]
Từ kết quả trên: O2 tham gia phản ứng (2) là 0,05mol.Nên Fe cần cho phản ứng (2) là: 0,075mol. => Chất rắn C gồm: 0,025 mol Fe3O4 và (0,1 - 0,075) = 0,025mol Fe dư và có khối lượng: 0,025. 232 + 0,025. 56 = 7,2 (g)+ Cho toàn bộ chất rắn C vào dd HCl :

TL
1/ nAl = 5,4 : 27 = 0,2(mol)
4Al + 3O2 ---> 2Al2O3
0,2 ----> 0,1 (mol)
=> mAl2O3 = 0,1 x ( 27 x 2 + 16 x 3 ) = 0,2 x 102 = 20.4 (g)
2/ nAl2O3 = 30,6 : 102 = 0,3 (mol)
4Al + 3O2 ---> 2Al2O3
0,6 <---- 0,3 (mol)
=> mAl = 0,6 x 27 = 16,2 (g)
3/ B1 : Viết phương trình
B2 : Tính số mol các chất
B3 : Dựa vào phương trình hóa học tính được số mol chất cần tìm
B4 : Tính khối lượng.
Áp dụng: 1. C
2. B
3. B
Khi nào rảnh vào kênh H-EDITOR xem vid nha!!! Thanks!

Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.
A