Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
c) \(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt

Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
a) Pt : 2Al +6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 3
0,5 1,5 0,75
a) Số mol của nhôm
nAl = \(\dfrac{0,75.2}{3}=0,5\left(mol\right)\)
Khối lượng của nhôm
mAl = nAl . MAl
= 0,5 .27
= 13,5 (g)
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,5.6}{2}=1,5\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch axit clohdric đã dùng
CMHCl = \(\dfrac{n}{V}=\dfrac{1,5}{0,5}=3\left(M\right)\)
Chúc bạn học tốt
2Al+6HCl->2AlCL3+3H2
=>nAl=\(\dfrac{2}{3}\)nH2=\(\dfrac{2}{3}\).16,8/22.4=0,5mol
=>mAl=27.0,5=13,5g
=>nHCl=2nH2=2.16,8/22,4=1,5mol
\(=>Cm=\dfrac{1,5}{\dfrac{500}{1000}}=3M\)

a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
____0,15<--0,3<-------------0,15
=> mFe = 0,15.56 = 8,4 (g)
b) \(C_{M\left(ddHCl\right)}=\dfrac{0,3}{0,05}=6M\)

a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\)
\(50ml=0,05l\)
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
\(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{HCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt
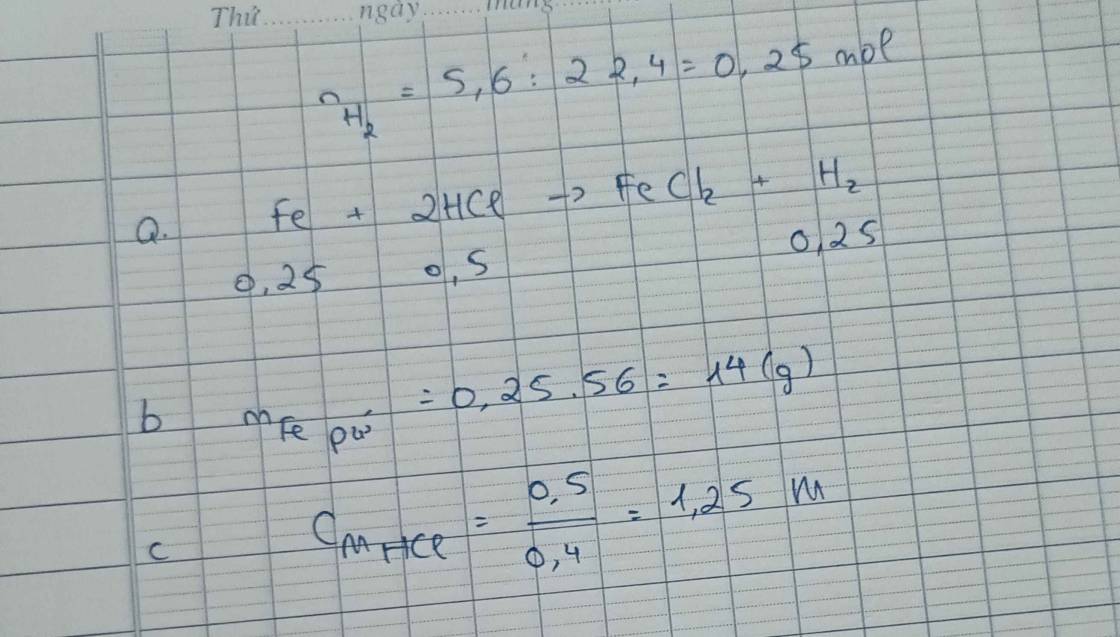

Câu 1:
a, - Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước có quỳ tím.
+ Không tan: MgO
+ Tan, quỳ hóa xanh: Na2O
PT: \(Na_2O+H_2O\rightarrow2NaOH\)
+ Tan, quỳ hóa đỏ: P2O5
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- Dán nhãn.
b, - Dẫn lần lượt từng khí qua bình đựng nước vôi trong.
+ Nước vôi trong vẩn đục: SO2
PT: \(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\)
+ Không hiện tượng: O2
c, - Trích mẫu thử.
- Cho từng mẫu thử pư với dd NaCl.
+ Có tủa trắng: AgNO3
PT: \(AgNO_3+NaCl\rightarrow NaNO_3+AgCl_{\downarrow}\)
+ Không hiện tượng: CuSO4, NaOH (1)
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: CuSO4
PT: \(BaCl_2+CuSO_4\rightarrow CuCl_2+BaSO_{4\downarrow}\)
+ Không hiện tượng: NaOH.
- Dán nhãn.
Câu 2:
a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{FeCl_2}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,3\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
d, \(m_{FeCl_2}=0,15.127=19,05\left(g\right)\)