Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Cu không tác dụng với dd HCl.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\Rightarrow m_{Cu}=19,4-13=6,4\left(g\right)\)
c, Ta có: \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{19,4}.100\%\approx67,01\%\\\%m_{Cu}\approx32,99\%\end{matrix}\right.\)
Bạn tham khảo nhé!

a) Gọi số mol Al, Mg là a, b
=> 27a + 24b = 6,3
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Mg + 2HCl --> MgCl2 + H2
b--------------------------->b
=> \(1,5a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}m_{Al}=0,1.27=2,7\left(g\right)\\m_{Mg}=0,15.24=3,6\left(g\right)\end{matrix}\right.\)
b)
PTHH: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,3}{y}\)<--0,3
=> \(M_{M_xO_y}=x.M_M+16y=\dfrac{17,4}{\dfrac{0,3}{y}}\)
=> \(M_M=21.\dfrac{2y}{x}\left(g/mol\right)\)
Xét \(\dfrac{2y}{x}=1\) => Loại
Xét \(\dfrac{2y}{x}=2\) => Loại
Xét \(\dfrac{2y}{x}=3\) => Loại
Xét \(\dfrac{2y}{x}=\dfrac{8}{3}\) => MM = 56 (g/mol) => M là Fe
a, ptpứ:
\(Mg+2HCl\rightarrow MgCl_2+H_2\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(2\right)\)
gọi số mol Mg là x mol , số mol Al là y mol ( x; y >0)
ta có pt : \(24x+27y=6,3\left(3\right)\)
theo bài : \(nH_2=0,3mol\)
theo ptpư(1) \(nH_2=nMg=xmol\)
theo ptpư(2) \(nH_2=\dfrac{3}{2}nAl=\dfrac{3}{2}ymol\)
tiếp tục có pt : \(x+\dfrac{3}{2}y=0,3\left(4\right)\)
từ (3) và (4) ta có hệ pt:
\(24x+27y=6,3\\ x+\dfrac{3}{2}y=0,3\)
<=> \(x=0,15\) ; \(y=0,1\)
\(mMg=24x=24.0,15=3,6gam\)
\(mAl=27y=27.0,1=2,7gam\)

mFe3O4 = 34.8 / 232 = 0.15 (mol)
nH2 = 8.96 / 22.4 = 0.4 (mol)
Fe3O4 + 4H2 -t0-> 3Fe + 4H2O
Bđ: 0.15.......0.4
Pư: 0.1..........0.4........0.3........0.4
Kt: 0.05.........0............0.3.......0.4
mFe3O4(dư) = 0.05 * 232 = 11.6 (g)
mFe = 0.3 * 56 = 16.8 (g)
VH2O = 0.4 * 22.4 = 8.96 (l)
2Fe + 6H2SO4(đ) => Fe2(SO4)3 + 3SO2 + 6H2O
0.3...........0.9.................0.15...........0.45
mH2SO4 = 0.9 * 98 = 88.2 (g)
C% H2SO4 = 88.2 * 100 / 98 = 90 %
VSO2 = 0.45 * 22.4 = 10.08 (l)
mX = 16.8 + 98 - 0.45 * 64 = 86 (g)
C% Fe2(SO4)3 = 0.15 * 400 / 86 * 100% = 69.76%

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Ag}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+108y=4,2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,15
\(\Rightarrow m_{Al}=0,1\cdot27=2,7g\)
\(\Rightarrow m_{Ag}=4,2-2,7=1,5g\)
a)\(\%m_{Al}=\dfrac{2,7}{4,2}\cdot100\%=64,28\%\)
\(\%m_{Ag}=100\%-64,28\%=35,72\%\)
b)\(m_{muối}=0,05\cdot342=17,1g\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1<-------------------------0,15
=> \(\%m_{Al}=\dfrac{0,1.27}{9,1}.100\%=29,67\%=>\%m_{Cu}=100\%-29,67\%=70,33\%\)

Fe + 2HCl -> FeCl2 + H2
nFe = 5,6/56 = 0,1 mol
=>nH2 = 0,1 mol
=> VH2= 0,1*22,4= 2,24 lít
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,1-->0,2------------------>0,1
=> \(\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,2.36,5}{15\%}=\dfrac{146}{3}\left(g\right)\\V_{H_2}=0,1.22,4=4,48\left(l\right)\end{matrix}\right.\)
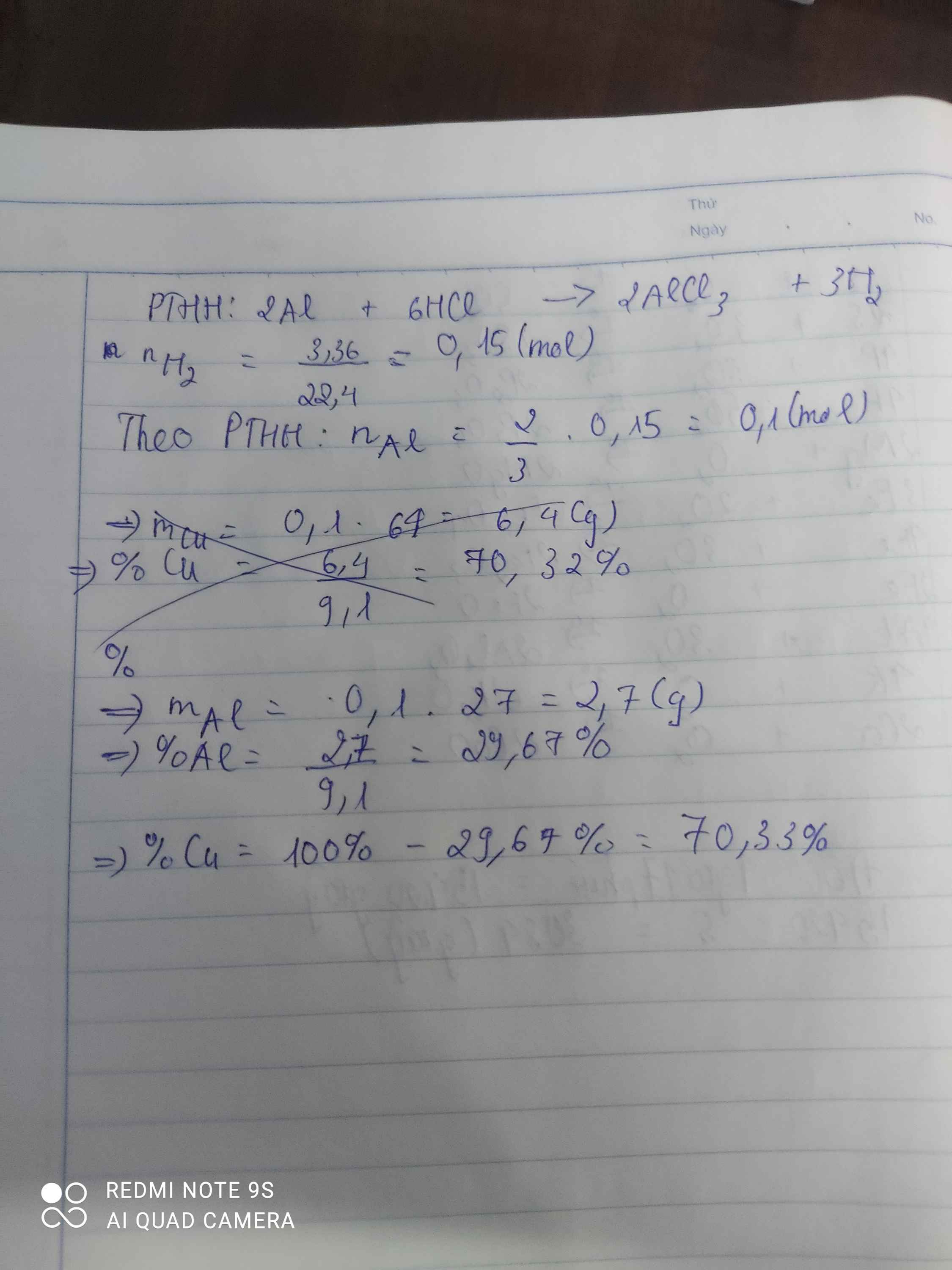
Câu 1 :
gọi số mol Mg phản ứng là a, mol Cu phản ứng là b
n H2 = 5,6/22,4 = 0,25 mol
PT
Mg + 2HCl -> MgCl2 + H2
a_____2a______a_____a__ (mol)
Cu + 2HCl -> CuCl2 + H2
b____2b_____b______b__ (mol)
n H2 = a+b = 0,25 (I)
mhỗn hợp kl = 24a + 64b = 10 (II)
giải Hệ PT I,II ta được
a = 0.15
b = 0.1
-> nHCl phản ứng = 2*0,15 + 2* 0,1 = 0,5 mol
-> mHCl phản ứng = 0,5 * 36,5 = 18,25 g
-> C% HCl (dd phản ứng) = 18,25/120 *100% = 15,21%
m dung dịch sau phản ứng = 120 +10 = 130g
C% Cu (dd sau) = 64*0,1 /130 *100% = 4,92%
C% Mg (dd sau) = 24*0,15 / 130 *100% = 2,77%
c, n CuO = 32/ 80 = 0,4 mol
PT CuO + H2 - > Cu + H2O
nx: 0,4/1 > 0,25/1 -> H2 hết, CuO dư, sản phẩm tính theo H2
theo PT nCu = nH2 = 0,25 mol
-> mCu = 0,25 * 64 = 16g