Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có lẽ đề cho nung kết tủa trong không khí chứ không phải "để" bạn nhỉ?
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
____0,04_____0,04_____0,04 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,03_____0,03______0,03 (mol)
⇒ nCuSO4 dư = 0,1 - 0,04 - 0,03 = 0,03 (mol)
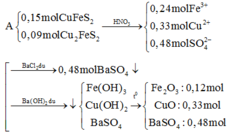
- Dung dịch X gồm: ZnSO4: 0,04 (mol), FeSO4: 0,03 (mol) và CuSO4: 0,03 (mol)
PT: \(ZnSO_4+Ba\left(OH\right)_2\rightarrow Zn\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
______0,04__________________0,04______0,04 (mol)
\(Zn\left(OH\right)_2+Ba\left(OH\right)_2\rightarrow BaZnO_2+2H_2O\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03______0,03 (mol)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow Cu\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03_______0,03 (mol)
- Kết tủa thu được gồm: Fe(OH)2: 0,03 (mol), Cu(OH)2: 0,03 (mol) và BaSO4: 0,1 (mol)
PT: \(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
_________0,03_________0,015 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
0,03_________0,03 (mol)
⇒ m = mFe2O3 + mCuO + mBaSO4 = 0,015.160 + 0,03.80 + 0,1.233 = 28,1 (g)

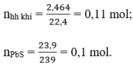
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

nhh=0,11 mol
n PbS=0,1 mol
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.

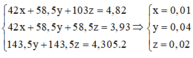
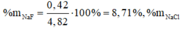
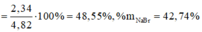


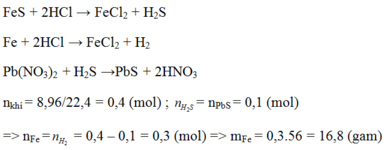
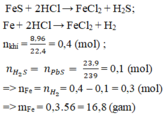
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
\(x\) \(x\)
\(MgCO_2+2HCl\rightarrow MgCl_2+H_2O+CO_2\uparrow\)
\(y\) \(y\)
Thu đc kết tủa \(BaSO_4\)
\(n_{BaSO_4}=\dfrac{1,7475}{233}=0,0075mol=n_{Ba\left(OH\right)_2dư}\)
\(\Rightarrow n_{Ba\left(OH\right)_2PƯ}=0,0225-0,0075=0,015mol=n_{BaCO_3}\)(BT Ba)
\(\Rightarrow n_{CO_2}=n_{BaCO_3}=0,015mol\left(BtC\right)\)
Ta có:
\(\left\{{}\begin{matrix}100x+84y=1,42\\x+y=n_{CO_2}=0,015\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,005\end{matrix}\right.\)
\(m_{CaCO_3}=0,01\cdot100=1g\)
\(m_{MgCO_3}=0,005\cdot84=0,42g\)