
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 16:
PTHH: \(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cl_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\n_{NaOH}=\dfrac{600\cdot20\%}{40}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) 2 chất p/ứ hết
Mặt khác: \(m_{Cl_2}=1,5\cdot71=106,5\left(g\right)\)
\(\Rightarrow m_{nướcjaven}=m_{Cl_2}+m_{ddNaOH}=706,5\left(g\right)\)

Câu 1 :
\(NaCl+H_2SO_{4\left(đ\right)}\rightarrow NaHSO_4+HCl\)
\(2HCl\underrightarrow{dp}H_2+Cl_2\)
\(H_2S+4Cl_2+4H_2O\rightarrow8HCl+H_2SO_4\)
\(Cu+2H_2SO_{4\left(đ\right)}\rightarrow CuSO_4+SO_2+2H_2O\)
Câu 3:
- Nhiệt phân KMnO4 tạo ra oxi
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
- Cho tinh thể NaCl vào dd H2SO4 đặc nóng tạo HCl
PTHH: \(2NaCl_{\left(rắn\right)}+H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Na_2SO_4+2HCl\uparrow\)
- Đổ HCl vào MnO2 tạo khí Clo
PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2\uparrow+2H_2O\)


\(a.Tacó:\left\{{}\begin{matrix}2Z+N=60\\2Z-N=4\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}Z=16\\N=28\end{matrix}\right.\\ Z=16\Rightarrow Cấuhìnhe:1s^22s^22p^63s^23p^4\)
b. Từ cấu hình e ta thấy:
Số lớp X : 3
Số e ở phân lớp năng lượng cao nhất là 4
c.\(X+2e\rightarrow X^{2-}\)
\(\Rightarrow CấuhìnheX^{2-}:1s^22s^22p^63s^23p^6\)

Lớp K
- số e tối đa của phân lớp s : 2
- số e tối đa của lớp : 2
- sự phân bố electron trên các phân lớp: 1s2
Lớp L
- số e tối đa của phân lớp s : 2
số e tối đa của phân lớp p : 6
- số e tối đa của lớp : 8
- sự phân bố electron trên các phân lớp: 2s22p6
Lớp M
- số e tối đa của phân lớp s : 2
số e tối đa của phân lớp p : 6
số e tối đa của phân lớp d : 10
- số e tối đa của lớp : 18
- sự phân bố electron trên các phân lớp: 3s23p63d10

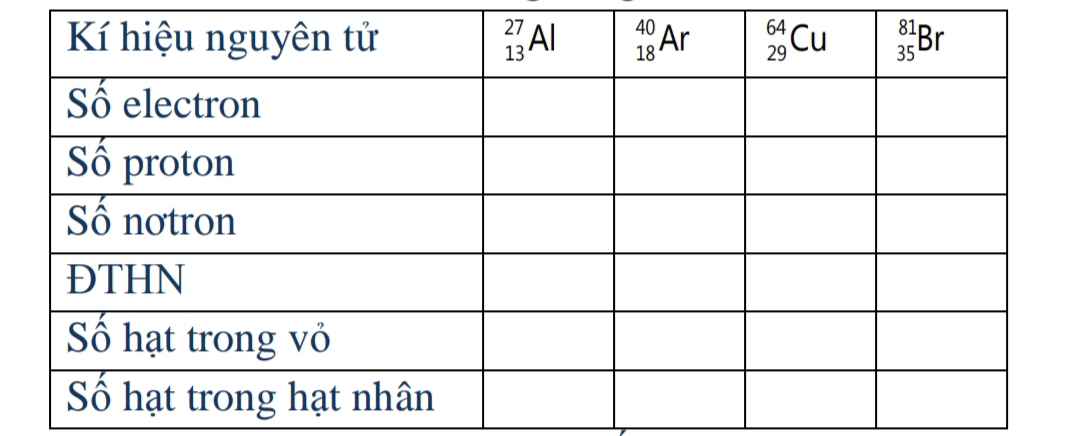
| Kí hiệu nguyên tử | \(\begin{matrix}27\\13\end{matrix}Al\) | \(\begin{matrix}40\\18\end{matrix}Ar\) | \(\begin{matrix}64\\29\end{matrix}Cu\) | \(\begin{matrix}81\\35\end{matrix}Br\) |
| Số electron | 13 | 18 | 29 | 35 |
| Số proton | 13 | 18 | 29 | 35 |
| Số notron | 14 | 22 | 35 | 46 |
| ĐTHN | 13+ | 18+ | 29+ | 35+ |
| Số hạt trong vỏ | 13 | 18 | 29 | 35 |
| Số hạt trong hạt nhân | 27 | 40 | 64 | 81 |

\(n_{FeS_2}=\dfrac{240}{120}.80\%=1,6\left(mol\right)\)
PTHH: 4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
1,6 -------------------------------> 3,2
2SO2 + O2 --to--> 2SO3
3,2 --------------------> 3,2
SO3 + H2O ---> H2SO4
3,2 ----------------> 3,2
\(m_{ddH_2SO_4}=\dfrac{3,2.98}{49\%}=640\left(g\right)\)










Câu 4:
PTHH: \(Zn+S\underrightarrow{t^o}ZnS\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{0,65}{65}=0,01\left(mol\right)\\n_S=\dfrac{0,384}{32}=0,012\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) Lưi huỳnh còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{ZnS}=0,01\left(mol\right)\\n_{S\left(dư\right)}=0,002\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{ZnS}=0,01\cdot97=0,97\left(g\right)\\m_{S\left(dư\right)}=0,002\cdot32=0,064\left(g\right)\end{matrix}\right.\)
Câu 4: (Bonus)
Ta có: \(n_{FeS}=\dfrac{17,6}{88}=0,2\left(mol\right)\)
Bảo toàn nguyên tố Lưu huỳnh: \(n_{FeS}=n_{PbS}=0,2\left(mol\right)\)
\(\Rightarrow m_{PbS}=0,2\cdot239=47,8\left(g\right)\)