Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
E gồm axit dạng C n H 2 n - 2 O 2 (đơn, hở, 1πC=C) và ancol dạng C m H 2 m + 2 (no, đơn, hở).
♦ giải đốt m gam E + 0 , 15 m o l O 2 → t 0 0 , 12 m o l C O 2 + 0 , 13 m o l H 2 O
Tương quan đốt: ∑ n H 2 O - ∑ n C O 2 = n a n c o l – n a x i t = 0 , 01 m o l 1
• bảo toàn nguyên tố O có 2 n a x i t + n a n c o l = 2 n C O 2 + n H 2 O - 2 n O 2 = 0 , 07 m o l 2
Giải hệ (1) và (2) có nancol = 0,03 mol và naxit = 0,02 mol.
→ ∑ n C O 2 = 0 , 02 n + 0 , 03 m = 0 , 12
⇒ 2n + 3m = 12 với m, n nguyên và n ≥ 3; m ≥ 1
⇒ cặp nghiệm duy nhất thỏa mãn là n = 3 và m = 2 tương ứng với hỗn hợp E gồm:
0,02 mol axit C H 2 = C H C O O H (axit acrylic) và 0,03 mol ancol C H 3 C H 2 O H (ancol etylic).
♦ phản ứng este hóa: C 2 H 3 C O O H + C 2 H 5 O H ⇄ C 2 H 3 C O O C 2 H 5 + H 2 O
ancol dư hơn axit (0,03 > 0,02)
⇒ hiệu suất tính theo số mol của axit
⇒ a = meste = 0,02 × 0,6 × 100
= 1,20 gam.

Chọn đáp án D
gt → X gồm ancol và axit đơn, hở đều chứa 1 π C = C
Xét phần 1: m X = 10 , 8 ( g ) ; n C O 2 = 0 , 5 m o l ; n H 2 O = 0 , 4 m o l .
Ta có: n C O 2 – n H 2 O = ( k – 1 ) . n H C H C với k là độ bất bão hòa của HCHC.
Áp dụng: ∑ n C O 2 – ∑ n H 2 O = n a x i t → n a x i t = 0 , 1 m o l . Bảo toàn khối lượng:
n O 2 = 22 + 7 , 2 – 10 , 8 ÷ 32 = 0 , 575 m o l . Bảo toàn nguyên tố Oxi:
n O / X = 0 , 5 × 2 + 0 , 4 – 0 , 575 × 2 = 0 , 25 m o l
→ n a n c o l = 0 , 25 – 0 , 1 × 2 = 0 , 05 m o l .
Đặt số C của ancol và axit lần lượt là m và n (m, n ≥ 3).
0,05m + 0,1n = 0,5. Giải phương trình nghiệm nguyên có: m = 4 và n = 3.
este là C2H3COOC4H7
→ n e s t e = 0 , 04 m o l .
Do n a n c o l < n a x i t
→ hiệu suất tính theo ancol.
H= 0,04 ÷ 0,05 × 100% = 80%

Đáp án B
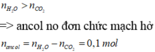
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
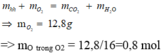
Áp dụng định luật bảo toàn nguyên tố oxi:
nO trong ancol + nO trong axit + nO trong O2
= nO trong CO2 + nO trong H2O
=> nO trong axit = 2.0,3 + 0,4 - 0,1 - 0,8 = 0,1 mol
=> naxit= 0,05 mol
Gọi m, n lần lượt là số ntử C của ancol, axit m ≠ n
=> 0,1m + 0,05n = 0,3
=> m =1, n=4
=> CTPT: CH3OH, C3H7COOH
=> CT este C3H7COOCH3
=> phản ứng este hóa, ancol dư 0,05 mol, axit hết
=> meste lí thuyết = 005.102 = 5,1 g
=> meste thực tế = 5,1.80% = 4,08g

Chọn đáp án B
đại diện 2 ancol no, đơn chức bằng ancol trung bình dạng CnH2n + 2O.
♦ giải đốt C n H 2 n + 2 + O 2 → t 0 0 , 175 m o l C O 2 + 0 , 3 m o l H 2 O
tương quan đốt: n a n c o l = n H 2 O – n C O 2 = 0 , 125 m o l
→ n = 0,175 ÷ 0,125 = 1,4.
không cần bận tâm 2 ancol là gì, lượng bao nhiêu vì đề không yêu cầu nhé.!!!
► chú ý hiệu suất các phản ứng ĐỀU BẰNG 60% nên dùng ancol đại diện trên tạo este:
♦ phản ứng C H 3 C O O H ( d ù n g d ư ) + C n H 2 n + 2 O ⇄ C H 3 C O O C n H 2 n + 1 + H 2 O
• neste = 0,6nancol = 0,6 × 0,125
= 0,075 mol (vì axit dùng dư, hiệu suất tính theo ancol).
• Meste = 15 + 44 + 14n + 1
= 79,6 (thay giá trị n = 1,4 ở trên vào).
⇒ meste = n × M = 0,075 × 79,6
= 5,97 gam

Đáp án A
Định hướng tư duy giải
Ta có:
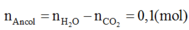
→ từ số mol CO2 suy ra ancol là CH3OH

Chọn đáp án A
Ta có : ![]() → từ số mol CO2 suy ra ancol là CH3OH
→ từ số mol CO2 suy ra ancol là CH3OH
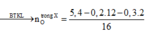
![]()
![]()
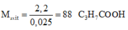
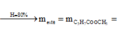
![]()


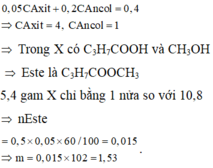

Chọn đáp án B
♦ giải đốt: 0 , 25 m o l E , T + O 2 → t 0 0 , 65 m o l C O 2 + 0 , 6 m o l H 2 O
có số Ctrung bình = 0,65 ÷ 0,25 = 2,6
⇒ Cancol E = 2 và Caxit T = 3 do nE < nT.
giải sơ đồ chéo giải rõ số mol có n C 2 = 0 , 1 m o l và n a x i t C 3 = 0 , 15 m o l .
Vậy có 0,1 mol ancol C2H5OH và 0,15 mol axit C3H?O2.
bảo toàn H có
? = (0,6 × 2 – 0,1 × 6) ÷ 0,15 = 4
⇒ axit là C3H4O2.
♦ Phản ứng este hóa: C H 2 = C H C O O H + C 2 H 5 O H ⇄ C H 2 = C H C O O C 2 H 5 + H 2 O
tỉ lệ phản ứng 1 : 1, số mol axit > ancol
⇒ hiệu suất phản ứng 60% tính theo số mol ancol.
⇒ m e t s e C H 2 = C H C O O C 2 H 5
= 0,1 × 0,6 × 100 = 6,00 gam