Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Q=100\cdot4,2\cdot8,3=3486J\\ \Delta_rH^o_{298}=-\dfrac{3,486kJ}{\dfrac{1,5g}{24g\cdot mol^{^{ }-1}}}=-55,776\left(kJ\cdot mol^{^{ }-1}\right)\)

1.
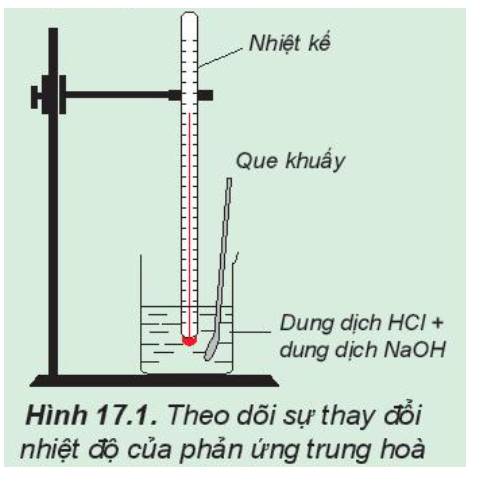
Phản ứng hóa học: NaOH + HCl → NaCl + H2O
Nhiệt độ đo được (HCl) lúc ban đầu thấp hơn so với nhiệt độ sau phản ứng
=> Phản ứng trung hòa là phản ứng tỏa nhiệt
2.
Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ sau phản ứng vẫn tăng nhưng tăng ít hơn so với thí nghiệm trên.

(1), (2) Thay a gam Fe hạt thành a gam Fe bột hoặc dạng lá → làm tăng diện tích tiếp xúc của
Fe với H2SO4 → làm tăng tốc độ
(3) 0,5 M < b → làm giảm nồng độ của H2SO4 → làm giảm tốc độ phản ứng
(4) Tăng thể tích H2SO4 làm giảm nồng độ H2SO4 →tốc độ phản ứng giảm
(5) Tăng gấp đôi nồng độ phản ứng → tốc độ phản ứng tăng
(6) Tăng nhiệt độ tốc độ phản ứng tăng
Vậy có 4 yếu tố làm tăng tốc độ phản ứng. Đáp án C.

a) Tốc độ phản ứng tăng lên (tăng diện tích bề mặt).
b) Tốc độ phản ứng giảm xuống (giảm nồng độ chất phản ứng).
c) Tốc độ phản ứng tăng.
d) Tốc độ phản ứng không thay đổi.

A. Kẽm bột sẽ tiếp xúc với H2SO4 nhiều hơn nên tốc độ phản ứng nhanh hơn
B. Thêm 50 ml H2SO4 nhưng với nồng độ không đổi thì không làm thay đổi tốc độ phản ứng.
C. Thay bằng H2SO4 có nồng độ thấp hơn thì phản ứng sẽ xảy ra chậm hơn
D. Đun nóng dung dịch làm tốc độ phản ứng nhanh hơn
→ Đáp án B

Chọn đáp án C
n C l 2 = 1 , 12 22 , 4 = 0,05 (mol); n N a O H d ư = 0,2.0,5 = 0,1 (mol)
C l 2 + 2NaOH → NaCl + NaClO + H 2 O
0,05 0,1 (mol)
=> n N a O H b đ = 0,1 + 0,1 = 0,2 (mol) => C M N a O H = = 1,0 (M)

Đáp án B
A, Kẽm bột sẽ tiếp xúc với H2SO4 nhiều hơn nên tốc độ phản ứng nhanh hơn
B, Thêm 50 ml H2SO4 nhưng với nồng độ không đổi thì không làm thay đổi tốc độ phản ứng
C, thay bằng H2SO4 có nồng độ thấp hơn thì phản ứng sẽ xảy ra chậm hơn
D, đun nóng dung dịch làm tốc độ phản ứng nhanh hơn
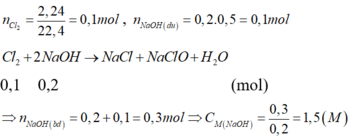
\(Q=25\cdot4,2\cdot7=735J\\ \Delta_rH^o_{298}=\dfrac{0,735kJ}{0,025\cdot0,2mol}=147kJ\cdot mol^{-1}\)