Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
hhX gồm 0,3 mol C2H4; 0,15 mol C2H2 và 0,5 mol H2.
Đun nóng X với Ni → hhY có dY/H2 = 13,3.
• Theo BTKL; mX = mhh ban đầu = 0,3 x 28 + 0,15 x 26 + 0,5 x 2 = 13,3 gam
→ nX = 13,3 : (13,3 x 2) = 0,5 mol.
Ta có:
nH2phản ứng = nhh ban đầu - nX = (0,3 + 0,15 + 0,5) - 0,5 = 0,45 mol.
nπ trước phản ứng = 1 x nC2H4 + 2 x nCH≡CH
= 0,3 + 2 x 0,15 = 0,6 mol.
→ nπ dư = nπ trước phản ứng - nH2 = 0,6 - 0,45 = 0,15 mol
→ nBr2 = 0,15 mol

Đáp án C
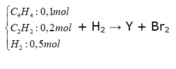
Số mol H2 phản ứng = nX - nY
Mà nY = mY : 28,5. mY = mX = 0,5.2 +0,1.52 + 0,2. 26= 11,4 mol → nY = 0,4 mol
→ nH2 (phản ứng ) = 0,8 -0,4 =0,4 mol
Ta có nH2 phản ứng + nBr2 = 0,1.3 + 0,2.2 = 0,7
→ nBr2 =0,3 mol → m = 48 g

Đáp án C
Có nX = 0 , 5 × 26 + 0 , 4 × 52 + 0 , 65 × 2 19 , 5 × 2 = 0,9 mol
Có nH2 pư = 0,5 +0,4 + 0,65- 0,9 = 0,65 mol
Chất tạo kết tủa với AgNO3/NH3dư gồm
CH≡CH dư : x mol, CH2=CH-C≡CH : y mol và CH≡C-CH2-CH3 : z mol
Ta có hệ →

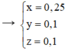
→ m = 0,25×(26 + 107.2) + 0,1×(52 + 107) + 0,1×(54 + 107) = 92 gam.

Khi cho hỗn hợp gồm ![]() và
và ![]() , H2 có chứa bột Ni nung nóng một thời gian thì các phản ứng có thể xảy ra:
, H2 có chứa bột Ni nung nóng một thời gian thì các phản ứng có thể xảy ra:
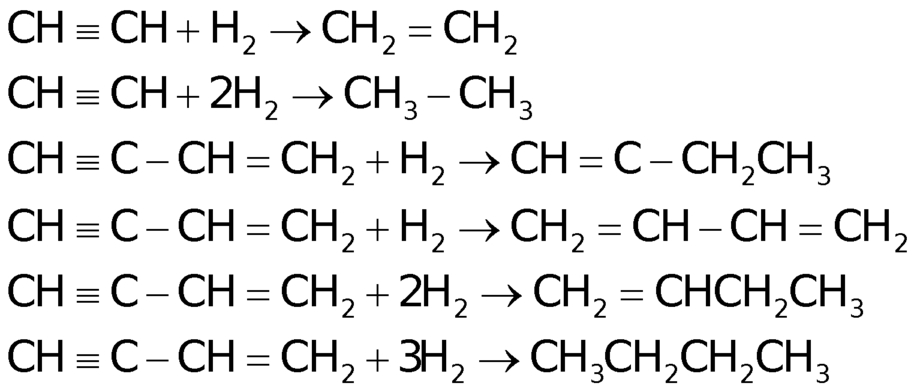
Có nhiều phản ứng có thể xảy ra tương ứng với nhiều sản phẩm. Do đó chúng ta cần biện luận dựa vào giả thiết đề bài để tìm ra thành phần của hỗn hợp khí X. Đây là một bài tập khá phức tạp, nếu chưa xác định được ngay hướng làm thì ta sẽ phân tích lần lượt các giả thiết:
Đầu tiên, áp dụng định luật bảo toàn khối lượng ta có:
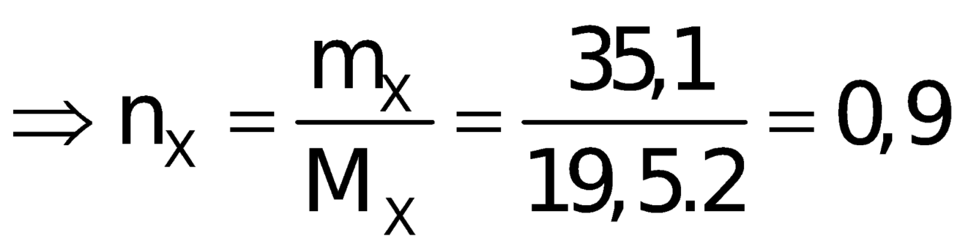
![]()
=> nH2 phản ứng= n khí giảm= n khí bđ - nX
![]()
Mà nH2 ban đầu=0,65
Nên H2 đã phản ứng hết và trong X chỉ gồm các hidrocacbon.
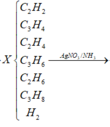
Vì X có phản ứng tạo kết tủa với dung dịch AgNO3/ NH3 nên trong X có chứa các hidrocacbon có liên kết ba đầu mạch, các hidrocacbon này có thể là ![]() và
và ![]() .
.
Mặt khác MX = 19,5.2 = 39
Khi cho X qua dung dịch AgNO3/ NH3 có thoát ra khí Y với nY = 0,45.
Mà ![]() nên n liên kết(Y)=nBr2=0,45
nên n liên kết(Y)=nBr2=0,45
Lại có n hidrocacbon phản ứng với AgNO3/NH3=nX-nY=0,45
Mà n AgNO3 phản ứng =0,7> 0,45 nên trong X chắc chắn chứa C2H2.
Trong X, gọi
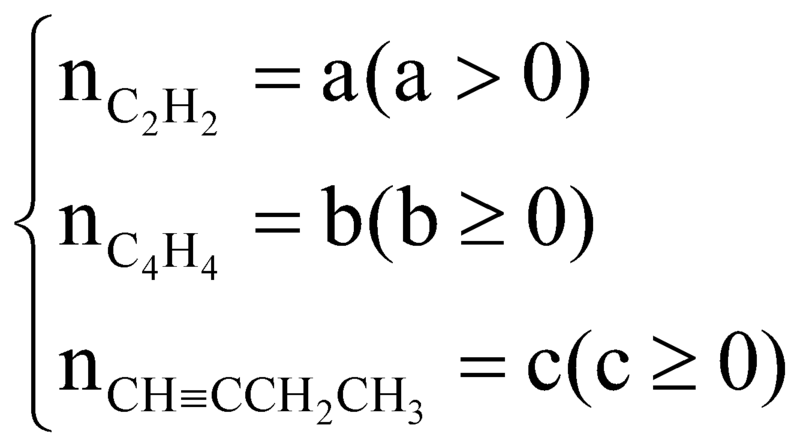
Ta có:
C2H2 -> Ag2C2
C2H4 -> AgC ≡ CCH=CH2
CH=CCH2CH3-> AgC ≡ CCH2ch3
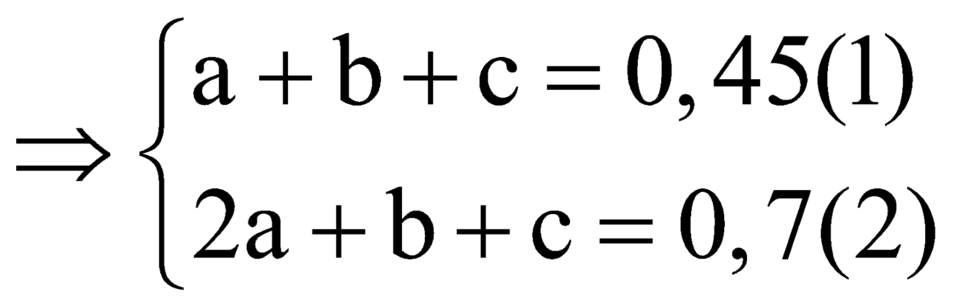
![]()
Từ (1), (2) và (3) có
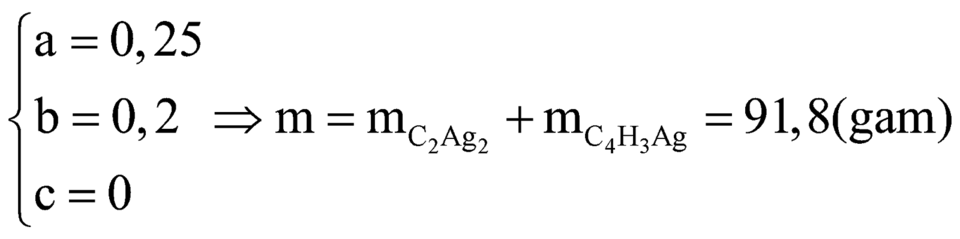

Đáp án A
BTKL: mX = mY → nY = mX : MY = (0,1. 52 + 0,2. 56 + 0,3. 28 + 0,4. 2) : 32 = 0,8
→ n(khí giảm) = n(X) – n(Y) = n(pi p.ư) = 0,1 + 0,2 + 0,3 + 0,4 – 0,8 = 0,2
→ n(Pi trong Y) = n(Pi trong X) – n(Pi p.ư) = (0,1. 3 + 0,2. 2 + 0,3. 1) – 0,2 = 0,8 → a = 0,8
→ Các mệnh đề đúng là a, b, d.
X, Y là hợp chất đơn chức, Z là hợp chất tạp chức

Bài 1:
Ta có: mX = mH2 + mC4H4 = 2,9 (g) = mY
\(M_Y=14,5.2=29\left(g/mol\right)\)
\(\Rightarrow n_Y=\dfrac{2,9}{29}=0,1\left(mol\right)\)
Mà: nX = 0,05 + 0,15 = 0,2 (mol)
Có: n hh giảm = nH2 (pư) = 0,2 - 0,1 = 0,1 (mol)
\(n_{Br_2\left(pư\right)}=n_{\pi\left(Y\right)}=n_{\pi\left(X\right)}-n_{H_2\left(pư\right)}=0,05.3-0,1=0,05\left(mol\right)\)
\(\Rightarrow m_{Br_2}=0,05.160=8\left(g\right)\)
Bài 2: Bài này số mol CO2 hơi xấu, không biết có nhầm lẫn gì không bạn nhỉ?
Bài 3:
Ta có: \(n_{C_3H_4}=n_{C_3H_3Ag}=\dfrac{14,7}{147}=0,1\left(mol\right)\)
Mà: \(n_{Br_2}=2n_{C_3H_4}+n_A=\dfrac{64}{160}=0,4\left(mol\right)\)
\(\Rightarrow n_A=0,4-0,1.2=0,2\left(mol\right)\)
Có: \(m_{C_3H_4}+m_A=12,4\left(g\right)\Rightarrow m_A=12,4-0,1.40=8,4\left(g\right)\)
\(\Rightarrow M_A=\dfrac{8,4}{0,2}=42\left(g/mol\right)\)
A có CTPT là CnH2n.
⇒ 12n + 2n = 42 ⇒ n = 3
Vậy: A là C3H6.
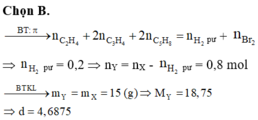
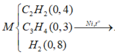
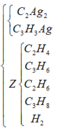
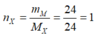
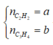
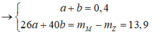
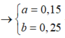
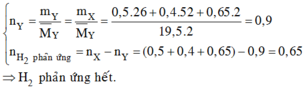
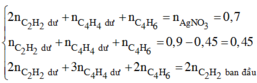
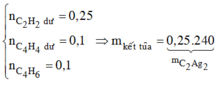
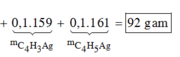
Đáp án D
Theo BTKL:
mX = mhh ban đầu = 0,5 x 2 + 0,15 x 52 = 8,8 gam.
→ nY = 8,8 : 22 = 0,4 mol.
→ nH2 phản ứng = nhh ban đầu - nX = 0,5 + 0,15 - 0,4 = 0,25 mol.
Ta có nπ trước phản ứng = 3 x nCH≡C-CH=CH2 = 3 x 0,15 = 0,45 mol.
Ta có
nπ dư = nπ trước phản ứng - nH2 phản ứng = 0,45 - 0,25 = 0,2 mol.
→ nBr2 = 0,2 mol
→ m = 0,2 x 160 = 32 gam