Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{HCl}=\dfrac{12,7}{36,5}=\dfrac{127}{365}\left(mol\right)\\n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\end{matrix}\right.\)
Ta thấy: \(2n_{H_2}< n_{HCl}\) \(\Rightarrow\) Axit còn dư
b) Theo PTHH: \(n_{HCl\left(p/ứ\right)}=2n_{H_2}=0,3\left(mol\right)\) \(\Rightarrow m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
Mặt khác: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl\left(p/ứ\right)}-m_{H_2}=18,65\left(g\right)\)
c) PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Khi 8 gam kim loại p/ứ với HCl dư tạo 0,15 mol H2
\(\Rightarrow\) 8 gam kim loại p/ứ với H2SO4 dư cũng tạo 0,15 mol H2
\(\Rightarrow n_{H_2}=n_{H_2SO_4\left(p/ứ\right)}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(p/ứ\right)}=0,15\cdot98=14,7\left(g\right)\)

a) 4,4 gam kim loại không tan là Cu
`=> m_{Cu} = 4,4 (g)`
`=> m_{Al} + m_{Mg} = 15,5 - 4,4 = 11,1 (g)`
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
`=> 27a + 24b = 11,1 (1)`
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2
a-------------------------->1,5a
Mg + 2HCl ---> MgCl2 + H2
b-------------------------->b
`=> 1,5a + b = 0,5(2)`
Từ `(1), (2) => a = 0,1; b = 0,35`
b) Đặt CTTQ của oxit kim loại là \(M_xO_y\) (M có hóa trị 2y/x và M có hóa trị n khi phản ứng với HCl)
PTHH:
\(M_xO_y+yH_2\xrightarrow[]{t^o}xM+yH_2O\)
Theo PTHH: \(n_{O\left(\text{ox}it\right)}=n_{H_2}=0,5\left(mol\right)\)
`=>` \(m_M=m_{M_xO_y}-m_{O\left(\text{ox}it\right)}=24,25-0,5.16=16,25\left(g\right)\)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(\dfrac{0,5}{n}\)<---------------------------0,25
`=>` \(M_M=\dfrac{16,25}{\dfrac{0,5}{n}}=32,5n\left(g/mol\right)\)
Chỉ có n = 2 thỏa mãn `=> M_M = 32,5.2 = 65 (g//mol)`
Vậy kim loại M là kẽm (Zn)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1<-------------------------0,15
=> \(\%m_{Al}=\dfrac{0,1.27}{9,1}.100\%=29,67\%=>\%m_{Cu}=100\%-29,67\%=70,33\%\)

Gọi x,y lần lượt là số mol của Al, Fe
nH2 = \(\dfrac{8,96}{22,4}\)=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt:
{27x+56y=11
1,5x+y=0,4
⇔x=0,2, y=0,1
% mAl = \(\dfrac{0,2.27}{11}\).100%=49,1%
% mFe = \(\dfrac{0,1.56}{11}\).100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,4}{y}\)<-------0,4
Ta có: 232,2=\(\dfrac{0,4}{y}\)(56x+16y)
⇔23,2=\(\dfrac{22,4x}{y}\)+6,4
⇔\(\dfrac{22,4x}{y}\)=16,8
⇔22,4x=16,8y
⇔x:y=3:4
Vậy CTHH của oxit: Fe3O4

PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Mg + 2HCl → MgCl2 + H2 ↑
Cu + HCl → Không phản ứng
%Cu trong hỗn hợp kim loại là: (2,5:12,7).100% = 19,7%
Khối lượng hỗn hợp Al và Mg là: 12,7 - 2,5 = 10,2 gam
Gọi số mol của Al là 2a , số mol của Mg là b
Số mol của H2 là: 11,2 : 22,4 = 0,5 mol
Ta có hệ pt:
- 27 . 2a + 24b = 10,2
- 3a + b = 0,5
=> a = 0,1 mol ; b = 0,2 mol
Khối lượng Al là: 27 . 2a = 27 . 2 . 0,1 = 5,4 gam
% Al trong hỗn hợp KL là: (5,4:12,7).100% = 42,52%
%Mg trong hỗn hợp là: 100% - 42,52% - 19,7% = 37,78%

nHCl (ban đầu) = 0,35 . 2 = 0,7 (mol)
nH2 = 6,72/22,4 = 0,3 (mol)
PTHH:
Mg + 2HCl -> MgCl2 + H2 (1)
2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo PTHH (1)(2)(3): nHCl (p/ư) = 2nH2 = 2 . 0,3 = 0,6 (mol)
So sánh: 0,6 < 0,7 => HCl dư
mHCl (p/ư) = 0,6 . 36,5 = 21,9 (g)
mH2 = 0,3 . 2 = 0,6 (g)
Áp dụng ĐLBTKL, ta có:
mkl + mHCl = m(muối) + mH2
=> m(muối) = 16 + 21,9 - 0,6 = 37,3 (g)

TN1: Gọi (nCu, nAl, nFe) = (a,b,c)
=> 64a + 27b + 56c = 14,3 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
b----------------------->1,5b
Fe + 2HCl --> FeCl2 + H2
c----------------------->c
=> 1,5b + c = 0,3 (2)
TN2: Gọi (nCu, nAl, nFe) = (ak,bk,ck)
=> ak + bk + ck = 0,6 (3)
\(n_{O_2}=\dfrac{44,8}{22,4}.20\%=0,4\left(mol\right)\)
PTHH: 2Cu + O2 --to--> 2CuO
ak--->0,5ak
4Al + 3O2 --to--> 2Al2O3
bk--->0,75bk
3Fe + 2O2 --to--> Fe3O4
ck-->\(\dfrac{2}{3}ck\)
=> 0,5ak + 0,75bk + \(\dfrac{2}{3}ck\) = 0,4 (4)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,1\left(mol\right)\\c=0,15\left(mol\right)\\k=2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,05.64}{14,3}.100\%=22,38\%\\\%m_{Al}=\dfrac{0,1.27}{14,3}.100\%=18,88\%\\\%m_{Fe}=\dfrac{0,15.56}{14,3}.100\%=58,74\%\end{matrix}\right.\)

ta có Cu không tác dụng với HCl nên lượng khí thoát ra là của Mg
pthh Mg + 2HCl => MgCl2 + H2
nH2 = 4.48 / 22,4 =0,2 mol mà nMg = nH2 =0,2
=> mMg= 0,2 * 24 =4,8g
mCu = 10 - 4,8 =5,2 g

\(a) m_{Cu} = 9,6(gam)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 27a + 56b = 16,55 -9,6 =6,95(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{3,92}{22,4} = 0,175(2)\\ (1)(2) \Rightarrow a = 0,05 ; b = 0,1\\ m_{Al} = 0,05.27 = 1,35(gam); n_{Fe} = 0,1.56 = 5,6(gam)\)
\(b) n_{HCl} = 2n_{H_2} = 0,175.2 = 0,35(mol) \Rightarrow m_{HCl} = 0,35.36,5 = 12,775(gam)\)
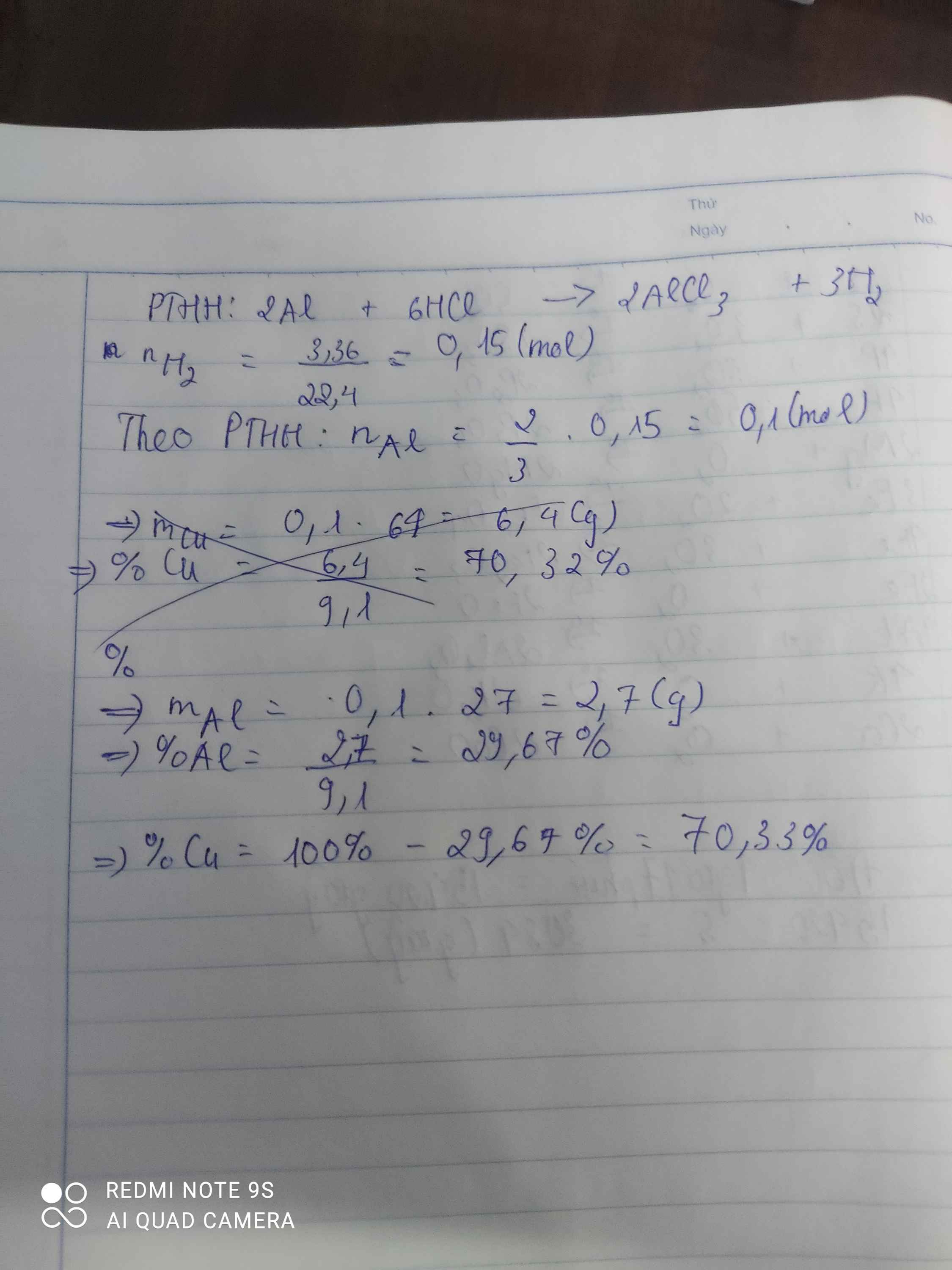
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.1..................................0.15\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Cu}=10-2.7=7.3\left(g\right)\)
\(\%m_{Al}=\dfrac{2.7}{10}\cdot100\%=27\%\)
\(\%m_{Cu}=73\%\)