Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Fe + CuSO 4 → FeSO 4 + Cu
n Fe = x mol
Khối lượng Fe phản ứng (cũng là khối lượng sắt trong hỗn hợp đầu) là 56x. Khối lượng Cu sinh ra 64x.
CuSO 4 dư nên chất rắn sau phản ứng là đồng :
10 - 56x + 64x = 11 → x = 1/8 mol
m Fe trong hỗn hợp đầu là: 56 x 1/8 = 7g
% m Fe = 7/10 x 100% = 70%
% m C u = 100% - 70% = 30%

Sau phản ứng, thu được hỗn hợp kim loại, suy ra kẽm dư.
$n_{CuSO_4} = \dfrac{80.30\%}{160} = 0,15(mol)$
$Zn + CuSO_4 \to ZnSO_4 + Cu$
$n_{Zn\ pư} = n_{CuSO_4} = 0,15(mol)$
$\Rightarrow m_{Zn\ pư} = 0,15.65 = 9,75(gam)$
Sau phản ứng, $m_{dd} = 9,75 + 80 - 0,15.64 = 80,15(gam)$
$C\%_{ZnSO_4} = \dfrac{0,15.161}{80,15}.100\% = 30,13\%$

mCuSO4 = 80.30% = 24 gam ==> nCuSO4 = 0,15 mol
dung dịch có 80-24 = 56 gam H2O
Zn + CuSO4 → ZnSO4 + Cu
Sau phản ứng thu được 16,1 hỗn hợp kim loại nên sau phản ứng phải có Zn dư và CuSO4 phản ứng hết.
nZn phản ứng = nCuSO4 = 0,15 ==> mZn = 0,15.65=9,75 gam
Chất tan trong dung dịch thu được là ZnSO4 = 0,15mol
mZnSO4 = 0,15.161= 24,15 gam
m dung dịch sau phản ứng = mH2O + mZnSO4 = 80,15 gam
C%ZnSO4 = \(\dfrac{24,15}{24,15+56}.100\)= 30,13%
b.
Hỗn hợp kim loại A gồm Zn dư và Cu : 0,15 mol
=> mZn = 16,1 - 0,15.64= 6,5 gam <=> nZn = 0,1 mol
Cho A tác dụng với HCl chỉ có Zn phản ứng
Zn + 2HCl --> ZnCl2 + H2
0,1 --------------> 0,1
==> VH2 = 0,1 .22,4 = 2,24 lít

\(m_{cr}=m_{Fe}=12.8\left(g\right)\)
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
\(m_{Al}=m_{hh}-m_{Fe}=18.2-12.8=5.4\left(g\right)\)
\(\%m_{Al}=\dfrac{5.4}{18.2}\cdot100\%=29.67\%\)

2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
x…………3/2.x
F e + C u S O 4 → F e S O 4 + C u
y……..y
Al phản ứng hết với C u S O 4 sau đó Fe mới phản ứng với C u S O 4 . Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ n C u = n C u S O 4 = 0,2.1 = 0,2 mol
⇒ m F e dư = m Y - m C u = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
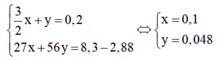
⇒ m A l = 0,1.27 = 2,7g
⇒ % m A l = 2,7/8,3.100 = 32,53%
⇒ Chọn A.

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

a, 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x…………3/2.x
Fe + CuSO4 → FeSO4 + Cu
y……..y
Al phản ứng hết với CuSO4 sau đó Fe mới phản ứng với CuSO4. Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ nCu = nCuSO4 = 0,2.1 = 0,2 mol
⇒ mFe dư = mY - mCu = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
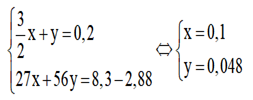
⇒ mAl = 0,1.27 = 2,7g
⇒ %mAl = 2,7/8,3.100 = 32,53%

câu này sai vì khối lượng rắn phải giảm
Chỉ có Zn phản ứng
\(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Vì CuSO4 dư nên Zn hết
Gọi số mol Zn là x \(\Rightarrow\) nZn=nCu sinh ra
\(\Rightarrow\) m rắn giảm= \(m_{Zn}-m_{Cu}=65x-64x=x\)